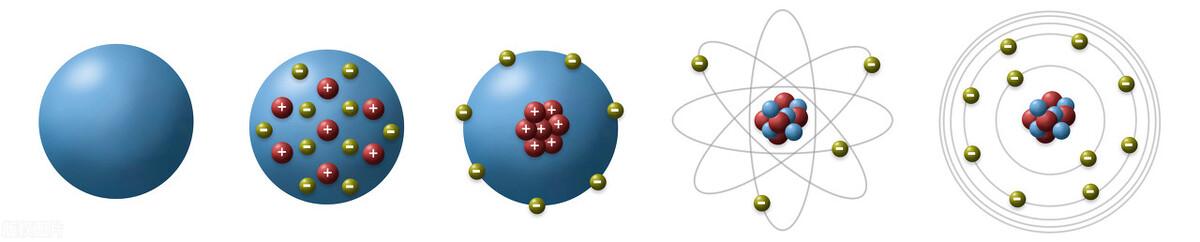
1、一些物质是由分子构成,分子由原子构成,那么原子是由什么构成的,可以再分吗?,科学家们对原子的结构做了大量的研究和探索,对原子的结构认识经历了以下几个历程。
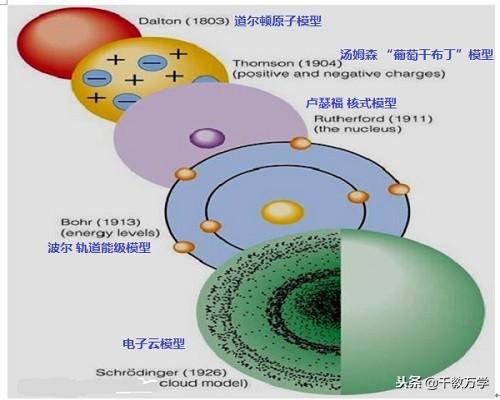
1.1、道尔顿(1803年提出:实心小球模型)

英国科学家道尔顿,认为原子是组成物质的最小单元,是个坚硬的不可分割的实心小球。他对原子结构认识有以下几点:
①原子是不可再分的粒子;
②原子是个实心小球;
③同种元素的原子的各种性质和质量都相等。
道尔顿的原子学说虽然不正确,但他第一个提出了原子的概念,为以后原子结构的研究奠定了基础。
1.2、汤姆森(1904年提出:葡萄干布丁模型)
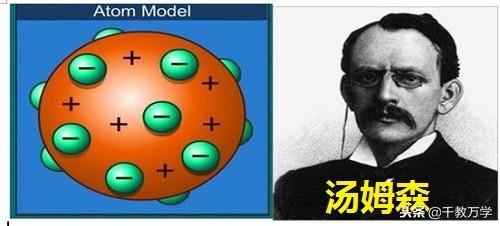
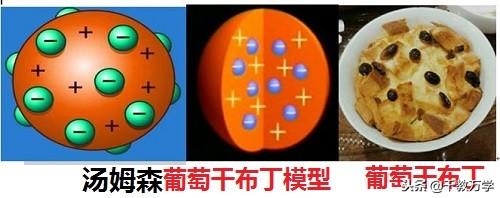
1897年英国物理学家汤姆森发现原子中存在电子,证明原子可分,并提出了“葡萄干布丁”的原子模型,认为原子是一个圆球状内充斥着正电荷,而带负电的电子像一粒粒葡萄干一样均匀相欠在其中。他对原子结构认识有以下几点:
①原子可以分为带负电的电子和带正电荷的物质;
②原子是个平均分布正电荷的球体,带负电的电子相嵌在其中;
③电子是静止不动的。
1.3、卢瑟福(1911年提出:核式模型或行星模型)
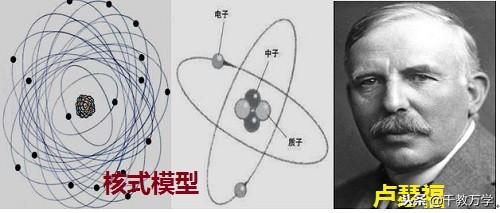
1909年著名物理学家卢瑟福通过α粒子散射实验(也叫金箔实验),提出了原子的核式模型。
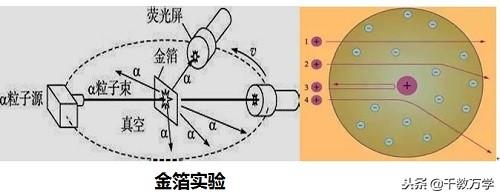
α粒子散射实验:用一束带正电的α粒子去轰击金箔,发现大多数α粒子都能穿过金箔,且发生很小的偏转,很少的α粒子发生大的偏角,极少数α粒子发生超过90度的偏转,极个别的α粒子发生180度角偏转而反弹回来。
核式原子的结构模型的基本观点:
①原子质量几乎全部集中在直径很小的带正电的原子核上;
②原子内部大部分体积是空的;
③带负电的电子随意的绕带正电荷的原子核运动;
1.3、波尔原子模型(1913年提出:波尔量子化模型)
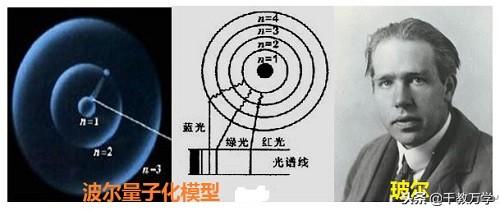
1913年波尔原子模型指出:电子不是随意占据在原子核的周围,而是在固定层面上运动。
波尔原子结构模型的基本观点:
①原子中的电子在具有确定半径的圆周轨道上,绕原子核运动;
②在不同轨道上的运动的电子具有不同的能量;
③当电子从一个轨道跃迁到另个轨道时,才会辐射或吸收能量。
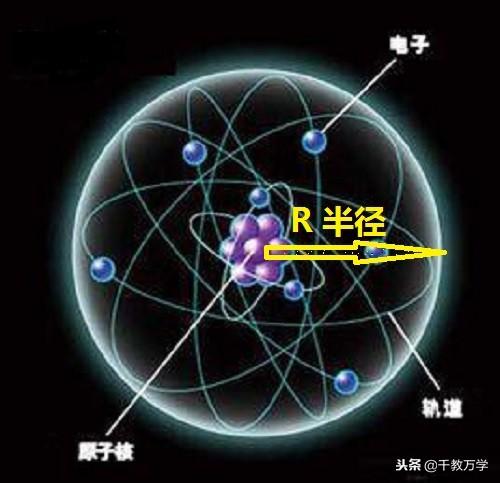
1.4、现代电子云模型(1926年提出)

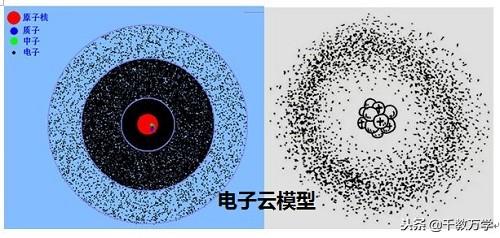
现代电子云原子模型指出,电子绕原子核运动形成一个带负电的云团,如上图。
2、原子结构的划分
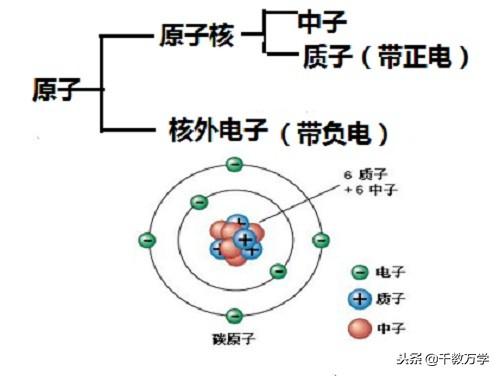
原子分为:原子核和核外电子(带负电);原子核分为质子(带正点)和中子(不带电);
2.1、原子核很小且原子质量主要集中在原子核上,电子的质量很小,几乎忽略不计。
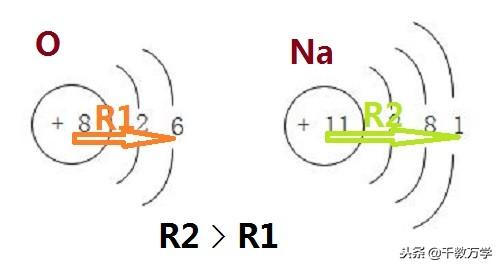
2.2、原子的体积与半径
原子体积和半径的大小和电子层数密切相关,一般情况下电子层数越多的原子的体积与半径越大,
如氧原子(O)核外有二个电子层,钠原子(Na)有三个电子层。所以氧原子的半径和体积小于钠原子。
3、原子结构示意图
原子结构示意图是表示原子核电荷数和电子层排布图示,比较直观的表示原子的结构。
3.1、原子结构示意图认识
以氧(Na)原子的结构示意图为例:
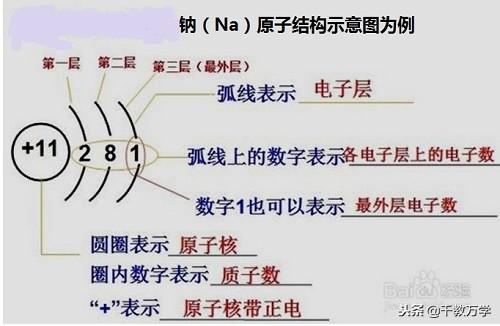
电子层上电子的简单排列方法:第一层最多只能放2个电子,最外层最多只能放8个电子。初中只要掌握1~20号元素的原子原子结构示意图。
3.2、原子结构示意图的书写方法
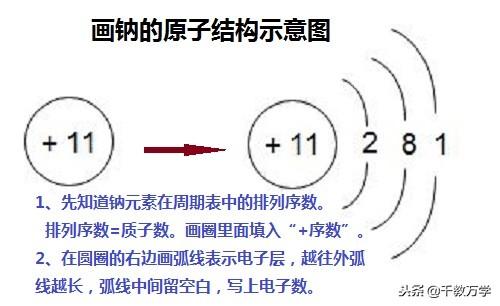
①由已知原子画出原子结构示意图(1~20号元素以),以钠为例:
第一步:找到钠元素在元素周期表中的排列序数(即质子数),将“+序数”写入圆圈内,
第二步:后在根据第一层、等二层、第三层…依次写上2、8、1…,最后保证正电荷数等于核外电子数。
②由原子结构示意图写出粒子种类(1~20号元素)
第一步:根据圆圈中的数字,得到元素的质子数(即元素周期表中的排列序数);写出元素的符号
第二步:根据正电荷总数与核外电子总数来判断原子还是离子。
正电荷总数=核外电子总数:原子;

正电荷总数>核外电子总数:阳离子;

正电荷总数



发表评论