这是一篇划水摸鱼的课程note,刚考完化学原理期中,复习的时候整理了一份“我认为的”重难点List,就想着和知友们share一下。希望能帮到一些正在学化学原理的小朋友们~
PS:只是一份知识点List,没有任何deep insight,纯纯属于小镇做题家的应试产物QuQ1. 物质的状态


a:与分子间作用力有关,摩尔质量越大 a越大
b:与分子自身体积有关,分子半径越大 b越大
临界温度Tc:气体通过 加压液化 的 最高温度。
临界压力Pc:在 临界温度 下,使气体 液化 所需的 最低压力。
临界体积Vc:在 临界温度 和 临界压力 下,1mol气体所占有的 体积。
Tb, Tc < 室温:室温下 加压 不能 液化
Tb < 室温 < Tc:室温下 加压 能 液化
Tb, Tc > 室温:室温下 为液体

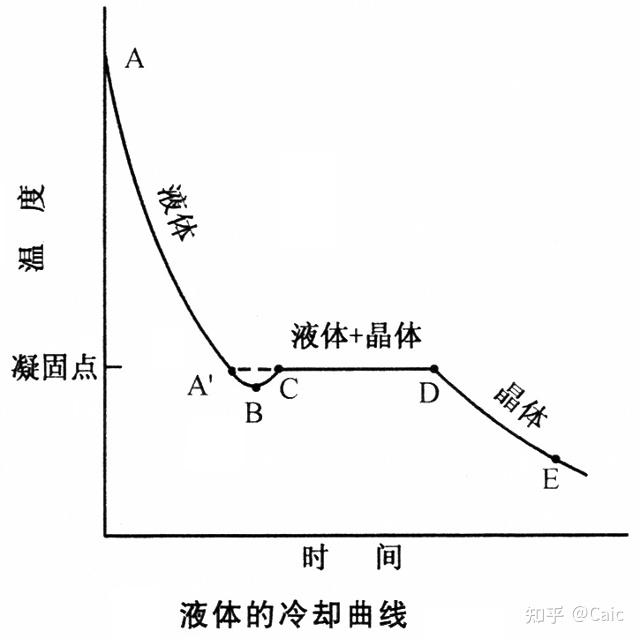
a)具有规则的几何外形,晶面夹角守恒定律;
b)有固定的熔点;
c)均匀性,各个部分的宏观性质相同;
d)各向异性,不同方向上的物理性质各不相同;
e)特定的对称性;
f)X射线衍射效应,晶体是天然立体光栅,粒子间距离与X光波长相当。

2. 原子结构
汤姆逊➡️葡萄干面包模型
威廉·克鲁克斯Crooks➡️阴极射线
Thomsom➡️电子荷质比
密立根➡️油滴实验
卢瑟福➡️核式(太阳-行星)模型
Moseley➡️原子序数
伦琴➡️X射线
Chadwick➡️中子
成功地解释了氢原子(和类氢离子)光谱产生的原因与规律性
可解释其它发光现象 (如X光的形成)
可计算氢原子的电离能
提出 n 是能级的概念,为现代物质结构理论的发展做出了贡献。
氢原子光谱的精细结构
氢原子光谱在磁场中的分裂
多电子原子的光谱
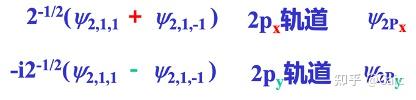

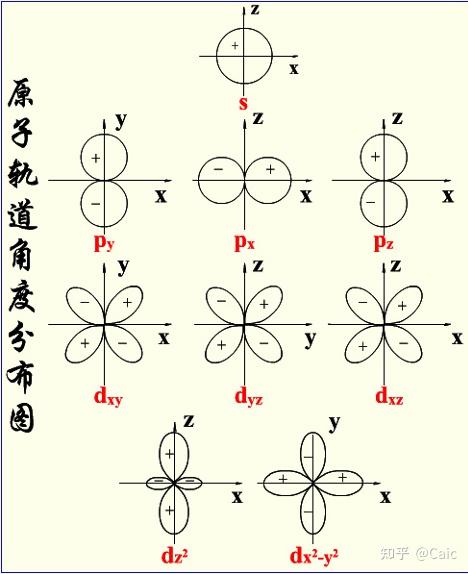

n ➡️决定 电子的能量
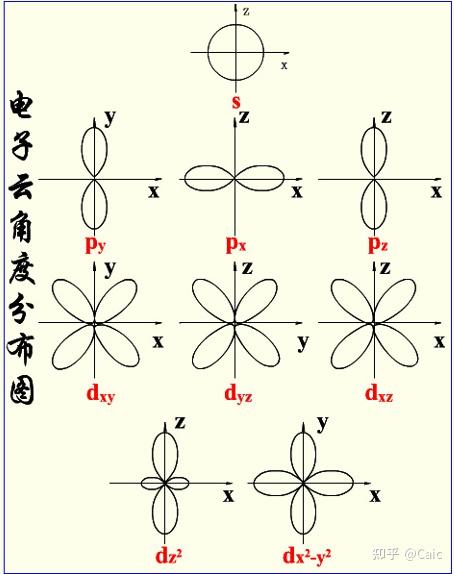
l ➡️电子云的形状 & 空间运动角动量的大小,影响 电子的能量
m ➡️电子云在空间中的伸展方向
ms➡️电子自旋
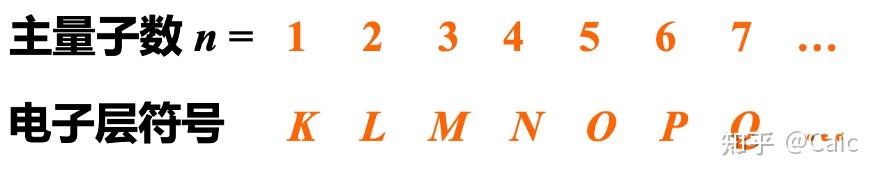
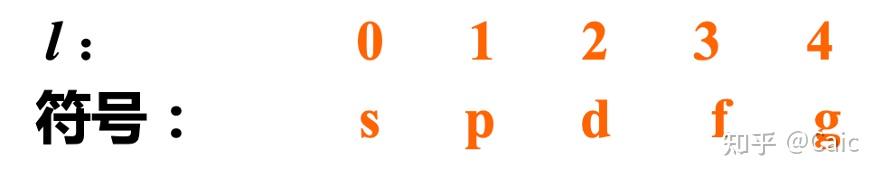

n l m ms ➡️电子的一种 运动状态
n l m ➡️电子的一种 空间 运动状态
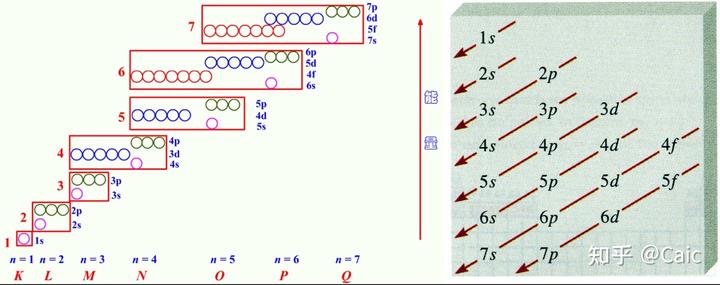
a)只适用于多电子原子,不适用于氢原子和类氢离子 ➡️它们不存在能级分裂
b)“顺序图”,表征电子的填充顺序,而不是实际能级

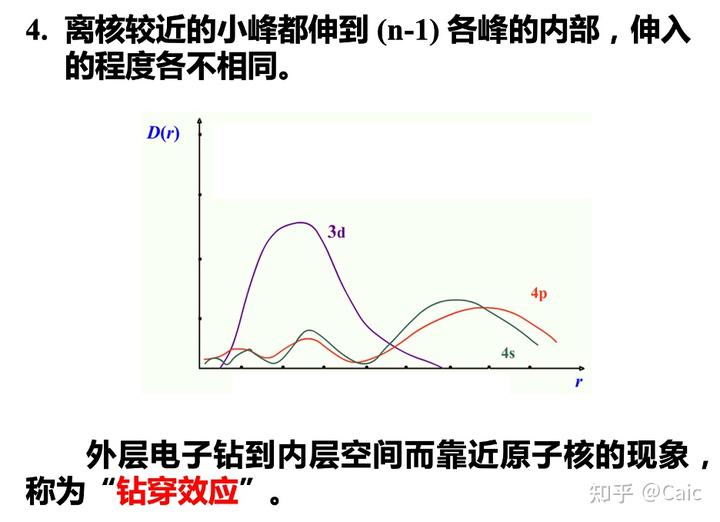
影响因素➡️产生屏蔽作用的电子的数目,这些电子所处原子轨道的大小、形状,该电子离核的远近、运动状态。
屏蔽强度➡️内层电子对外层电子的屏蔽作用较大;同层电子的屏蔽作用较小;外层电子对内层电子可近似看作不产生屏蔽作用
钻穿能力越强➡️受到的屏蔽作用越小➡️受核的引力越强➡️能量越低➡️能级分裂
能级分裂的程度很大➡️与邻近电子层中的亚层 发生 能级交错

特短周期:一
短周期:二、三
长周期:四、五
特长周期:六、七
内部效应:镧系中相邻元素的半径十分接近,用普通的化学方法将很难分离
外部效应:第5、6两周期的同族过渡元素性质极为相似,往往导致在自然界共生,而且相互分离不易。(Hf & Zr,Ta & Nb)
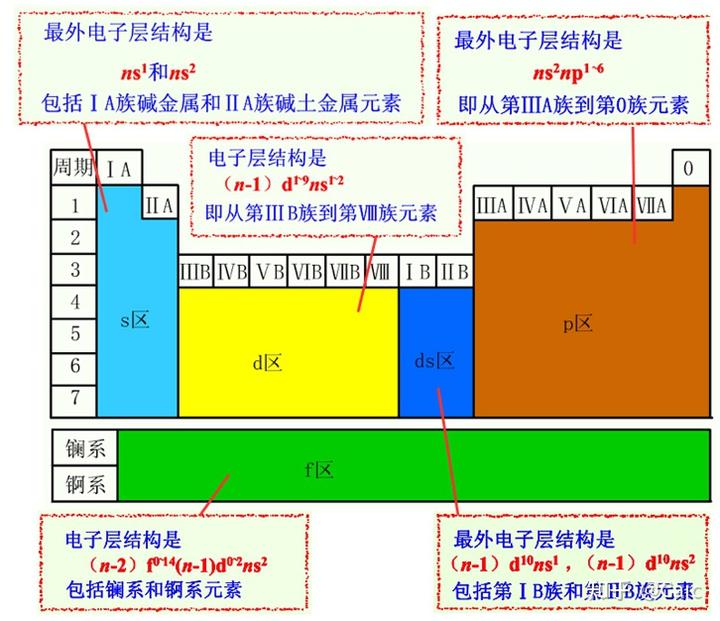
s区:活泼金属
d区:金属
ds区:no idea
p区:稀有气体、非金属、半导体
f区:镧系 & 锕系
过渡元素:d + ds
内过渡元素:f
主族:s区+p区,最后一个电子填入ns或np轨道
族数 = 最外层电子数 = 最高氧化数(O & F除外)
副族(过渡元素):d 区+ ds区,电子填入(n-1)d或(n-2)f轨道
IIIB~VIIB(d区):族数 = 价电子数 = 最外层s+次外层d
IB & IIB(ds区):族数 = 最外层电子数
定义➡️共价半径(共价单键,核间距离/2)、金属半径(相邻原子核半径/2)、范德华半径(稀有气体)
影响因素➡️电子层数、有效核电荷、洪特规则
减小幅度➡️主族(最外层) > 过渡(次外层) > 内过渡(倒数第三层)➡️屏蔽效应 依次增强,有效核电荷的增加 依次降低
定义➡️1mol 基态 气态 原子,失去电子,成为 1mol 气态 负离子
影响因素➡️有效核电荷数(正相关)、原子半径(负相关)、电子构型(洪特规则)
特例➡️Be>B, N>O, Mg>Al, P>S,第二、五主族
定义➡️1mol 基态 气态 原子,得到电子,成为 1mol 气态负离子
影响因素➡️有效核电荷数(正相关)、原子半径(负相关)、电子构型(洪特规则)
意义➡️原子得到电子的难易(程度)
特例➡️第二周期 > 第一周期,第二、五主族

定义➡️原子在分子中对成键电子吸引力相对大小的量度,金属性 / 非金属性
不同元素➡️右&上 大
同种元素➡️氧化数越高,电负性越大
计算方法➡️Pauling法 & Muliken法
3. 分子结构
键能:0K,1mol 基态 双原子分子 拆开所需的能量
键角:CH4 109.5;NH3 107;H20 104
键长、极性、键级
正:8
负:2;8;9~17;18;18+2(离子性减弱,共价性增强)
影响因素➡️电子层数、有效核电荷数、氧化数、负>正、对角线规则、镧系收缩
饱和性➡️轨道和未成对电子数一定
方向性➡️最大重叠原理
VP = BP + LP
Method 1:
s键电子对数 + 孤对电子对数
s键电子对数 = 与中心原子成键的原子数
孤对电子对数 = (中心原子价电子数 - 所有配位原子未成对电子数之和- 离子电荷数)/2
Method 2:
(中心原子价电子数 + 配位原子提供电子数 - 离子电荷数) ¸ 2
H与卤素为 1;O和S为 0;N为-1
1. π键等价于孤对电子
2. 排斥力:叁键>双键>单键
3. 配体电负性大、中心原子电负性小➡️键角小

多个原子上 相互平行的 p 轨道 连贯重叠在一起 构成一个整体, 而p 电子在这个 整体内运动所形成的键。

用➡️增加分子稳定性;影响物质的理化性质。
使得分子稳定性增加
酸碱性改变(一般变酸)
化学反应活性下降
带有颜色、极性键小、导电性增加
金属晶体➡️金属原子,金属键
离子晶体➡️阴阳离子,离子键
分子晶体➡️分子,分子间结合力
原子晶体➡️中性原子,共价键
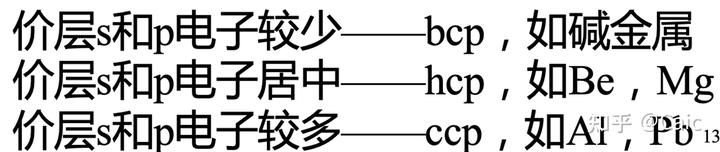
简单立方堆积(6)
体心立方堆积(8)
面心立方最密堆积(12)
六方最密堆积(12)
四面体空隙:一层的三个球与相邻层的第四个球之间的空隙
八面体空隙:一层的三个球与交错排列的另一层的三个球之间的空隙

Cl 立方最密堆积;Na 八面体空隙
配位比 6: 6,每个晶胞4Cl 4Na
Cl 简单立方堆积;Cs 立方体空隙
配位比 8: 8,每个晶胞 1Cs 1Cl
闪锌矿型,立方:
S 立方最密堆积,Zn 半数的四面体空隙
配位比4: 4,每个晶胞4S 4Zn
纤锌矿型,六方:
S 六方最密堆积,Zn 部分四面体空隙
配位比4: 4,每个晶胞2S 2Zn



取向力➡️极性 & 极性
诱导力➡️极性 & 极性/非极性,与温度无关
色散力➡️所有分子(主要)
4. 配合物
多为 金属正离子,特别是 过渡金属离子
单/多 核配合物
中性分子、阴离子、阳离子(罕见)➡️配位原子
单配位原子:单齿配位体、单基配位体
多配位原子:多齿配位体、多基配位体、螯合配体、螯合剂
多种配体➡️混配化合物
配体没有孤电子对➡️Zeise盐
单齿:中心原子的个数
多齿:提供sigma电子对的个数
影响因素➡️中心离子电荷(正相关)、半径(正相关)、配位体浓度(正相关)、温度(负相关)
“配体” 合“ 中心原子(价)” 酸 “外界金属阳离子”
“外界阴离子” 化 “配体” 合 “中心原子(价)”
多种配体,先阴离子,再中性分子(拉丁字母顺序),中间加“ · ”分开。
多种阴离子,先简单的,再复杂的,最后有机酸根离子
简单配合物、螯合物、多核配合物、羰合物、烯烃配合物、多酸型配合物
2:直线型
3:平面三角形
4:正四面体型(非过渡金属 & 过渡金属)(sp3杂化)、平面正方形(only过渡金属)(dsp2杂化)
5:三角双锥、四方锥
6:八面体(内轨型 d2sp3;外轨型 sp3d2)、三棱柱(少见)
空间异构:几何异构(顺反异构)、旋光异构(对映异构体)
结构异构:中心原子与不同的配体配位
成键➡️共价键
中心原子➡️杂化,提供空轨道;杂化方式,空间构型
配位原子➡️提供孤对电子
外:ns、np、nd杂化,高自旋,键能小,稳定性差,顺磁性
内:ns、np、n-1d杂化,低自旋,键能大,稳定性强,反磁性
成键➡️离子键
核心思想➡️晶体场对中心离子外层d电子的运动具有十分显著的影响➡️d轨道发生能级分裂
常见的晶体场➡️正方形场(强场)、正四面体场(弱场)、正八面体场
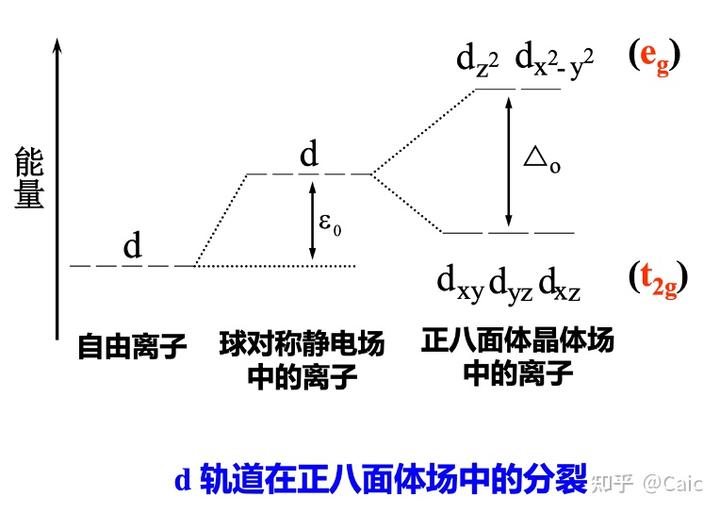
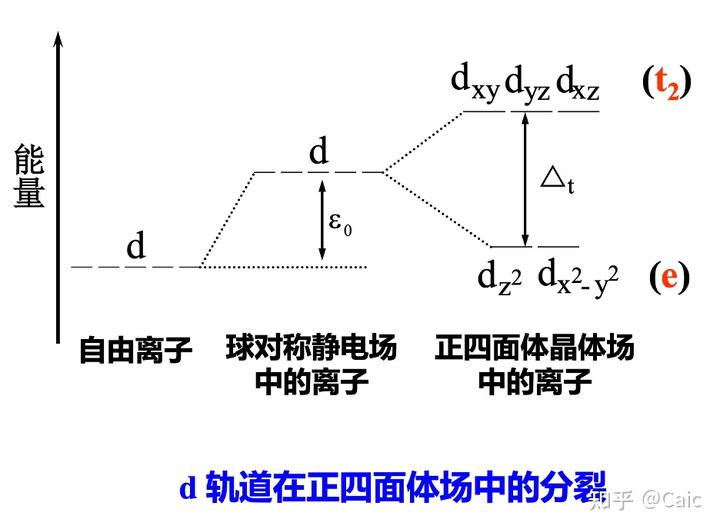
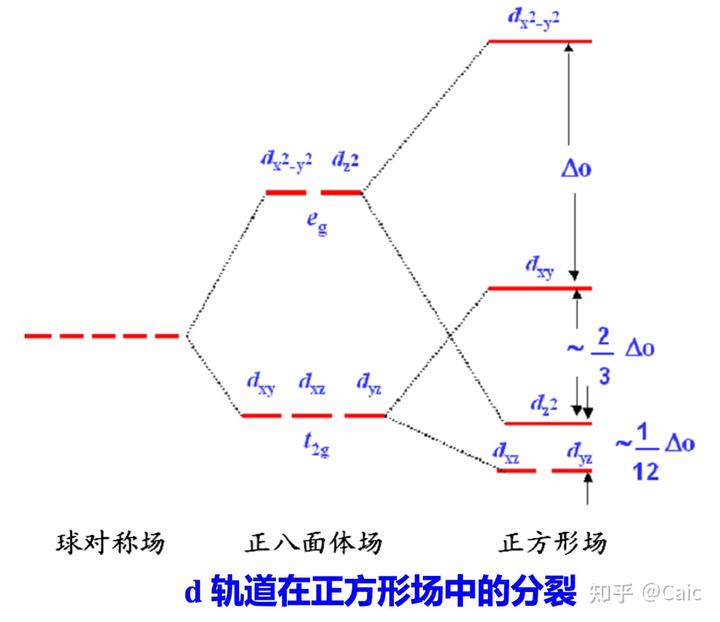
定义➡️d 轨道在晶体场中分裂后,最高能级与最低能级间的能量差
影响因素➡️配合物几何构型Dsq > Do > Dt、中心离子(电荷、周期数)(正相关)、配体种类
定义➡️d电子从 假想的球形场中未分裂的d轨道 进入 晶体场中分裂后的d轨道 所产生的总能量的下降值
影响因素➡️d电子数目、配位体强弱、晶体场类型
1. 预测 配合物的 高低自旋状态&磁性;
2. 解释 配合物的 颜色&吸收光谱,d-d跃迁;

发表评论