在阅读此文前,诚邀您点个“关注”,既方便您进行讨论和分享,又能带给您与众不同的参与感,感谢您的支持!
文丨纪实册编辑丨纪实册
大脑和免疫系统以双向方式连接,迄今为止,人们在很大程度上仍然不知道为什么免疫成分会受到抑制、增强或不受社会心理压力的影响,因此,我们混合了具有不同攻击性水平的不熟悉的猪。
我们通过皮肤病变、血浆皮质醇水平和从与重组相关的激动行为中获得的肌酸激酶活性,将去势的公猪和母猪分为心理社会高应激和低应激动物,死后收集外周血单核细胞(PBMC),并使用Affymetrix平台(n = 16)评估差异基因表达。

RNA分离、靶标制备和杂交,总共选择了16个样品(混合组平衡)进行后续分析,使用4ml血液,通过在Histopaque密度梯度上离心分离外周血单核细胞(PBMC),使用基于色谱柱的NucleoSpin RNA II试剂盒。
从单个PBMC样品中分离总RNA,通过2100生物分析仪和含有溴化乙锭的琼脂糖凝胶检查RNA完整性,RNA浓度由NanoDrop ND-1000光谱仪测量,通过猪GAPDH基因的PCR扩增检查基因组DNA的缺失。
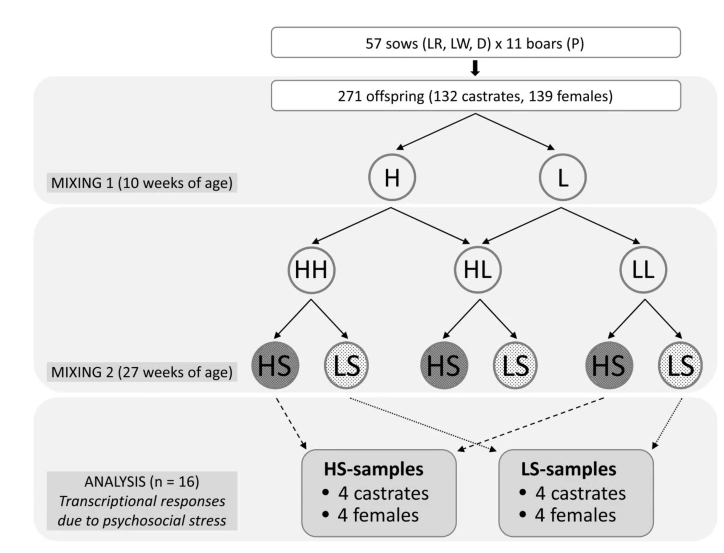
所有样品均储存在-80°C,直至进行下游分析,对于微阵列实验,单个生物素标记的cRNA由GeneChip 3'快速试剂盒合成,根据制造商的方案,cRNA在Affymetrix GeneChip猪24 k阵列上片段化和杂交,经过洗涤和染色程序后,对阵列进行扫描。
数据分析,总共有15个阵列中有16个通过了先前提出的适当质量控制标准,数据是GC-RMA归一化(Log2),为了通过排除不适当的探针集来提高统计功效,数据通过MAS5算法过滤,跳过每个实验组表达少于50%的探针集。
此外,那些显示小SD(SD
包括由胁迫水平,性别,屠宰批次,混合组和应激水平*性别表示的单个和综合效应(V艾克尔= μ + 压力水平我+ 性爱j+ 屠宰批次k+ 混合组l+(压力水平*性别)ij+ 错误艾克尔)。
由于应激水平而改变的转录模式,分析显示,706个探针组的mRNA丰度在p ≤0.05处发生变化,对应于0.24至0.36之间的q值,事实上,与LS样品相比,HS样品中只有2个探针集(Ssc.13877.1.A1_at和Ssc.3445.1.S1_at,分别注释为Trip11和ARL4C)在q
然而,为了获得关于应激反应引起的转录差异的第一个提示,我们将这个特定的基因列表(p ≤0.05; q ≤0.36)上传到IPA,HS和LS样本在许多免疫途径(HS>LS)内显示出偏差,包括TREM1信号传导,树突状细胞成熟,Toll样受体信号传导和IL-6信号传导。
因此,这些过程可能代表仅在数据集的特定子组中明显的转录改变,我们检查了方差分量应激水平*性别,以揭示基因表达机制的微妙修饰。
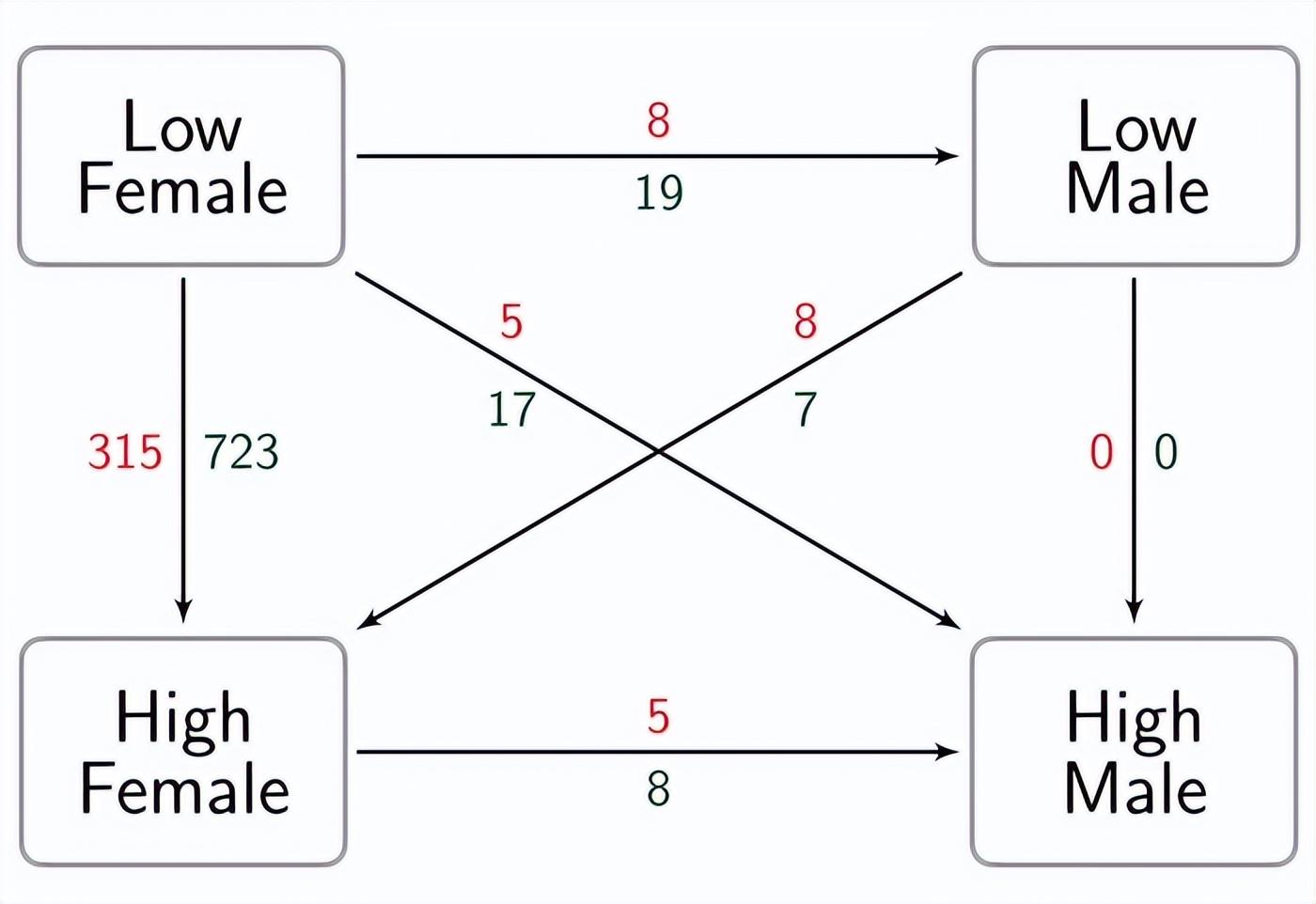
应激水平引起的性别依赖性mRNA改变,方差分析显示,由于压力水平与性别相互作用,mRNA丰度存在差异,特别是,仅在女性样本之间发现了相关的应力依赖性改变:比较HS女性和LS女性1,038个探针组显着差异(315个探针组:HS女性>LS女性)。
差异表达(倍数变化-FC)的幅度在18.8(HS女性>LS女性)和-4.2(HS女性
与 TREM 1 信号传导、树突状细胞成熟、IL-6 信号传导、Toll 样受体信号传导和 IL-8 信号传导相关的基因显示 HS 雌性 mRNA 丰度增加,使用Benjamini-Hochberg多次测试校正,在LS女性中没有发现单一途径增加。
根据应力水平和性别显示mRNA丰度变化的探针组数量,探针组在雌性之间有所不同,但在雄性动物之间则不同,红色和绿色数字分别表示转录本丰度较高和较低(例如,与LS雌性相比,315个探针组显示HS雌性中的mRNA丰度增加)。
尽管他们的应激水平存在明显差异,但男性样本之间的比较显示其表达谱没有改变(HS-男性= LS-男性),此外,女性和男性之间的其余比较仅显示微小的转录差异。
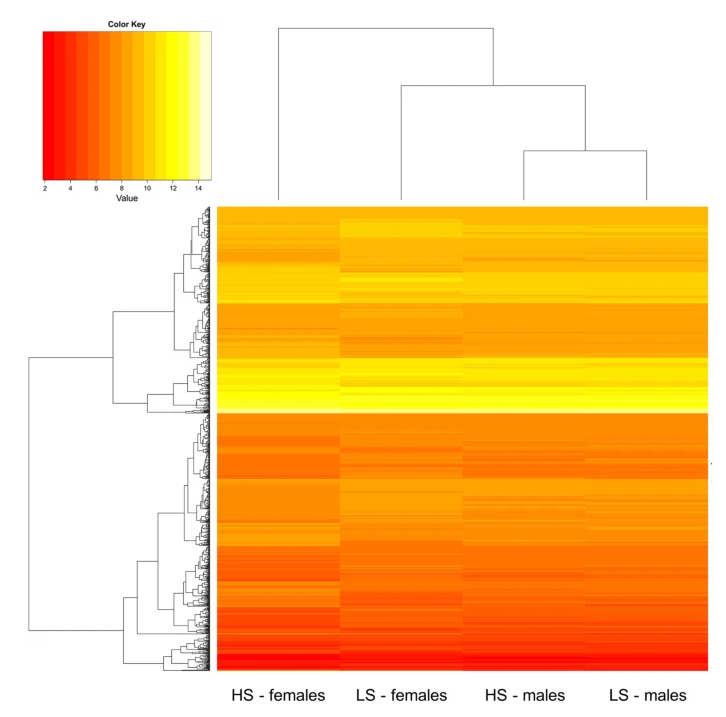
所有发现因方差分量应力水平*性别而不同的探针集都聚类,以估计出现的亚组(HS女性,HS男性,LS女性和LS男性)的关系,分析发现,与LS女性和男性样本相比,HS女性样本的转录反应最远,因此,雌性样本之间免疫途径的改变被认为是HS雌性的特定转录反应。
选定细胞表面受体的mRNA丰度的改变,编码免疫受体的各种转录本(CCR1,CCRL2,CD1D,CD14,CD19,CR2,CXCR7,IL13RA1,IL27RA,IL6R,IL7R,TLR2,TLR4,TNFRSF1,TNFRSF1B,TRAF5,TREM1)显示出不同的mRNA丰度,这取决于女性与HS或LS组的隶属关系。
但在男性中则不然,为了验证微阵列实验,通过qPCR分析了5种编码与免疫功能相关的细胞表面受体的选定转录本:CCR1,CD14,TLR2,TLR4和TREM1(表5),。
在微阵列分析方面,所选靶基因和参考基因的平均表达值(log2)在3.94至15.06之间,因此,该子集代表了表达值的分布,并突出了表达变异性和对数mRNA丰度的独立性。
在微阵列实验中,所有选定的转录本都显示雌性(HS雌性>LS雌性)之间的mRNA丰度显着改变,但雄性样品之间没有(q值>0.25),qPCR数据证实了性别特异性表达模式:编码细胞表面受体的4种选定转录本中有5种显示,与LS雌性相比。
HS雌性中的mRNA丰度增加,未发现男性样本之间的变化,此外,折叠变化揭示了一个可靠的维度,在微阵列和qPCR数据之间,相关系数非常显着,范围在0.87和0.93之间,综上所述,qPCR分析表明分析具有可重复性。
由于混合了不熟悉的猪,诱发了不同程度的社会心理压力,通过微阵列实验评估PBMC的转录转移,以深入了解将心理社会压力对免疫状态的影响引导的分子途径。
HS女性表现出对心理社会压力的转录反应,对各种哺乳动物的研究清楚地表明,免疫应答是性别二态的,本文似乎涉及性类固醇环境、HPA轴激素和免疫系统之间的复杂相互作用。
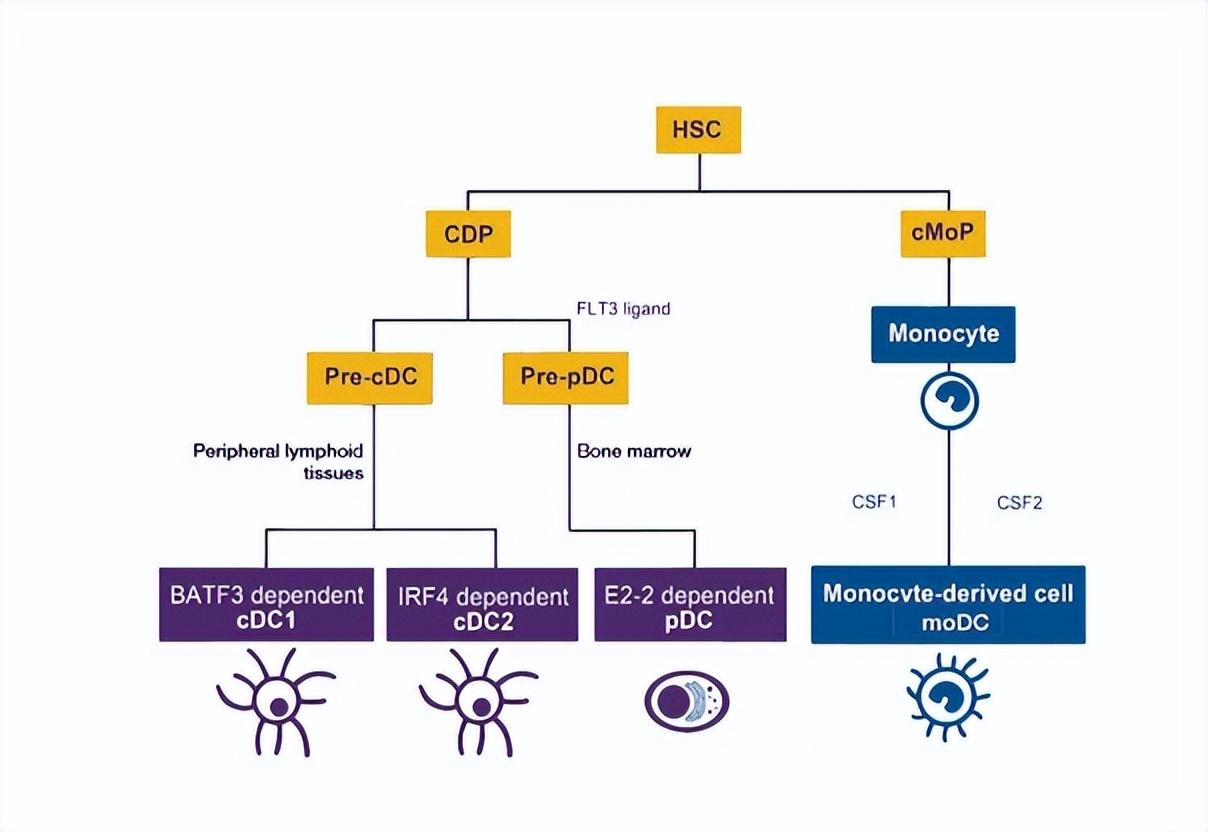
特别是,成年雌性哺乳动物比雄性具有更强的体液和细胞免疫力,在男性去势患者中,缺乏雄激素释放会中断HPA轴内的负反馈,并可能在内源性皮质醇增加后达到免疫抑制作用。
此外,去势会引起各种免疫改变,包括胸腺和脾脏器官重量的改变和成熟T细胞的数量,因此,在我们的研究中,由于压力水平和性别之间的相互作用,猪免疫转录物出现了显着的改变,有趣的是,聚类分析确定HS雌性在雌性和雄性样本中分离最多。
因此,我们的研究结果表明,免疫相关的适应主要发生在HS女性中,其中由此产生的基因表达差异可能代表短暂而不是持续的过程,有人可能会争辩说,观察到的mRNA改变可能与性成熟程度有关。
事实上,参与雌激素周期的性类固醇激素水平会影响免疫细胞分布,然而,两种17β-雌二醇(HS-女性:30.23±7.90pg/ml;LS-女性:26.52 ± 9.41 pg/ml)和黄体酮(HS 女性:0.40 ± 0.20 ng/ml;LS-雌性:0.29±0.21 ng/ml)被发现没有改变。
压力和免疫力,为了理解心理神经免疫学领域明显相反的结果,提出了一种多维方法,至少涉及社会地位、年龄、遗传背景、研究组织、一天中的时间,特别是应激源特征等因素。
Dhabhar得出结论,由生理浓度的内源性激素(例如皮质醇)介导的压力源作用于天然富含免疫细胞(例如血液,PBMC)的免疫室将揭示免疫增强作用,事实上,途径分析揭示的显着增加的分子路线(HS女性>LS女性)表明。
高心理社会压力涉及免疫系统在免疫增强方面的准备,然而,似乎很难评估观察到的mRNA改变是否反映了免疫抵抗和免疫耐受方面的生物阳性副作用。
许多研究表明,对心理社会压力的反应累积在不同组织和器官的适应机制中[36],从而影响免疫系统面对环境挑战, 因此,与LS女性相比,HS女性发现的免疫途径改变对应于先天性和适应性免疫机制。
包括与模式识别和炎症相关的过程,特别是,细胞表面受体显示HS女性的mRNA丰度增加和减少,表明免疫系统的微调是对心理社会挑战的反应,改变转录本产量中的特定细胞表面受体表明,社会应激生物体会调整其信号转导,以招架由于战斗时受伤而可能引起的感染。
由于大脑、行为、内分泌系统和免疫系统之间存在密切联系,已发现攻击性会激活下丘脑-垂体轴(HPA)和交感神经-肾上腺髓质(SAM)系统, 随后,适应性机制通过体液和细胞介质(即趋化因子和细胞因子)传播。
其转录和释放在狭窄的时间范围内产生,以调节各种免疫作用,因此,在我们的研究中,心理社会高应激猪在屠宰时血浆皮质醇增加,而编码分泌免疫因子的基因的转录改变仅观察到轻微。
这些发现与先前在啮齿动物中发现的结果一致,当时暴露于优势小鼠导致皮质酮水平升高,但在采样时循环细胞因子未受影响。
这些观察结果导致了普遍的看法,即分泌免疫因子的mRNA改变有助于“应激反应”现象,而细胞表面受体mRNA丰度的可能差异部分反映了“应激反应”的程度,因此,在这里我们观察到“压力反应”和“压力反应”的差异。
为了了解连接应激反应和免疫状态的分子途径,评估了PBMC对心理社会应激的转录反应,应激反应影响免疫活性细胞的转录本,并且似乎仅在女性中具有特异性性别。
在高压力和低压力组中,类固醇激素水平相似可能表明性激素对内分泌和免疫系统的直接影响与性别特异性影响无关,但可能对心理社会压力源的认知和感知产生影响。
社会心理高应激雌性动物的表达谱与获得性和先天免疫途径的转录变化有关,此外,除了免疫效应子的转录本外,分析还强调各种细胞表面受体的mRNA对应激敏感,应激依赖性表达模式表明免疫系统在反应和反应方面发出警报,这是由效应分子传递增加和受体安装介导的。






发表评论