1910年1月9日,昂格尔进行了他首次也是唯一的一次人肾异种移植手术。为挽救一位所有常规治疗均显示无效的21岁尿毒症晚期女性,她的治疗医生接受了昂格尔的建议,决定尝试进行肾移植手术,为病人的生命做最后的努力。昂格尔将一只猕猴的2个肾脏,移植到了受者左侧的股血管上。虽然缺血只持续了43 min,血管也未见血栓形成,但移植肾未显示出任何功能,受者于术后32 h死于肺水肿。昂格尔在其发表的论文中展示了本次手术的示意图,这也是人类器官移植史上的首张肾移植示意图()。
点击查看大图
图4
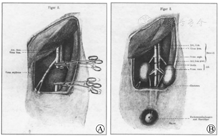
昂格尔的猕猴双肾异种移植手术示意图[]A.将猕猴双肾连同腹主动脉和下腔静脉整体切取后所见;B.将猕猴双肾的腹主动脉和下腔静脉与受者大腿上部股血管吻合
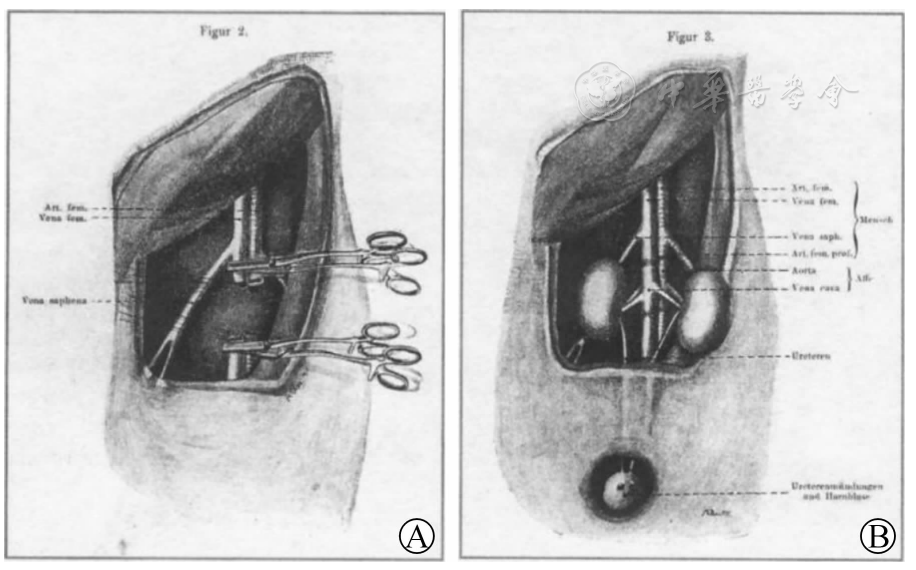
图4
昂格尔的猕猴双肾异种移植手术示意图[]A.将猕猴双肾连同腹主动脉和下腔静脉整体切取后所见;B.将猕猴双肾的腹主动脉和下腔静脉与受者大腿上部股血管吻合
昂格尔认为,移植可能会因为移植组织供受者之间的生化差异而导致手术失败,而不是因为手术技术问题。对昂格尔来说,肾移植手术技术的研究已经走到了尽头,他认为要想获得移植成功,必须首先设法克服人与动物之间的生化差异,否则肾移植很难成功。所以昂格尔再未进行进一步的肾移植研究,并从1910年起开始转向进行神经和血管移植研究[]。
在20世纪30年代前还有一些人对异种肾移植进行了尝试。1913年,申施塔特(Schonstadt)将一只日本猴子的肾脏移植到了一位因中毒而导致肾衰竭的小女孩手臂上。在产生了几滴尿液后,受者于术后60 h死亡。1923年,美国纽约的哈罗德·纽霍夫(Harold Neuhof)为一位汞中毒的受者移植了一个羊肾,未见移植肾有功能的报道,受者术后仅存活了9 d。在其他几例异种肾移植的尝试均宣告失败后,接下来的几十年里,再未见异种肾移植的临床尝试。
直到20世纪60年代,研究者们对移植免疫和组织相容性有了初步了解,并开发出了免疫抑制药物,临床器官移植才开始逐步开展,但移植的结果并不令人满意。同时,由于用于器官移植的人体器官来源问题仍未解决,激发了一些移植研究者再次探索临床异种移植的可能性,重启了临床异种移植的第2个时代,并掀起了一个异种肾移植的小高潮。
1963年2月16日,美国明尼苏达州明尼阿波利斯市的克劳德·希区柯克(Claude Hitchcock)将一只狒狒的肾脏移植给了一位65岁妇女,术后移植肾动脉血栓形成,受者仅存活了4 d。
美国新奥尔良的基斯·雷姆斯马(Keith Reemtsma,1925年12月5日至2000年6月23日,)认为,非人灵长类动物如黑猩猩的肾脏之所以引人关注,是因为它们与人类种系最接近,体积大小相近,且血型(A型和O型)相同。非人灵长类动物的肾脏有可能在人类体内发挥作用,因此是治疗肾衰竭的一种有效方法。

点击查看大图
图5
基斯·雷姆斯马[]

图5
基斯·雷姆斯马[]
1963年11月5日至1964年2月10日雷姆斯马和他的团队在杜兰大学(Tulane University,)进行了6例人类异种肾移植手术。雷姆斯马在第一阶段选择了6只黑猩猩切取肾脏后,移植给了6位终末期肾功能衰竭的受者。他整块切取黑猩猩的2个肾脏及其血管(包括主动脉和下腔静脉),再将其分别与受者的髂外动脉和髂外静脉吻合(),缺血时间在36~43 min之间。所有这些移植肾术后都立即发挥了功能,并能维持几周的功能,其中存活时间最长的受者存活了9个月[,]。

点击查看大图
图6
杜兰大学异种肾移植组成员[]

注:图中由右往左为雷姆斯马(Reemtsma)、施莱格尔(Schlegel)和麦克拉肯(McCracken)
图6
杜兰大学异种肾移植组成员[]
点击查看大图
图7
雷姆斯马实施的黑猩猩双肾移植手术过程示意图[]A.整块切取黑猩猩双肾;B.将整块黑猩猩双肾植入受者体内
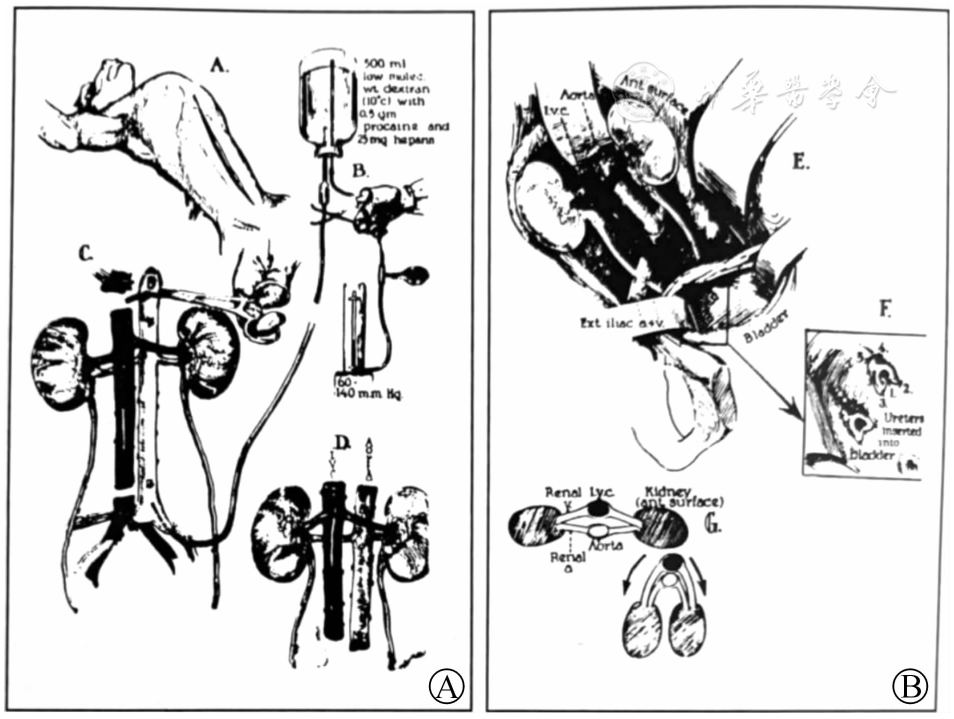
图7
雷姆斯马实施的黑猩猩双肾移植手术过程示意图[]A.整块切取黑猩猩双肾;B.将整块黑猩猩双肾植入受者体内
1963年11月5日,雷姆斯马第一次尝试将一只黑猩猩的肾移植给了43岁的杰弗逊·戴维斯(Jefferson Davis)医生,移植术后采用包括了硫唑嘌呤、放线霉素C、强的松和全身放射照射的免疫抑制治疗。移植63 d后,受者死于肺炎休克。
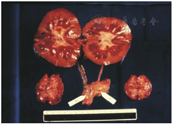
1964年,雷姆斯马及其同事进行了最成功的一例临床异种肾移植手术。受者是一位23岁的女教师,因慢性肾小球肾炎和严重尿毒症入院。在接受腹膜透析治疗后,她于1964年1月13日接受了黑猩猩肾的移植手术。受者在移植手术后服用了免疫抑制剂硫唑嘌呤和甲泼尼龙,并于术后第23天成功控制住了一次急性排斥反应。术后4个月,她的肾功能恢复并正常出院,也恢复了工作。然而,由于无法抑制慢性排斥反应,移植肾功能随后逐渐下降,抗排斥反应的治疗也未能逆转,术后9个月她死于心脏骤停。这可能是由于电解质紊乱,因为移植的黑猩猩肾过度排尿(通常大于20 L/d),黑猩猩的肾脏可能并不能具有与人类肾脏完全一样的功能。但尸检结果令人惊讶,她的移植肾并未见任何排斥反应的迹象,而且大体标本看起来很正常(),只有轻微的组织学改变。本例在移植肾功能丧失前存活了9个月,证明了异种移植的可行性,这也是有史以来异种器官移植存活时间最长的纪录。雷姆斯马之后还报道了12例非人灵长类肾异种移植给人类的一系列研究,但这些移植受者均没有获得超过9个月的存活时间[]。
点击查看大图
图8
移植后存活9个月的异种移植肾大体标本[]
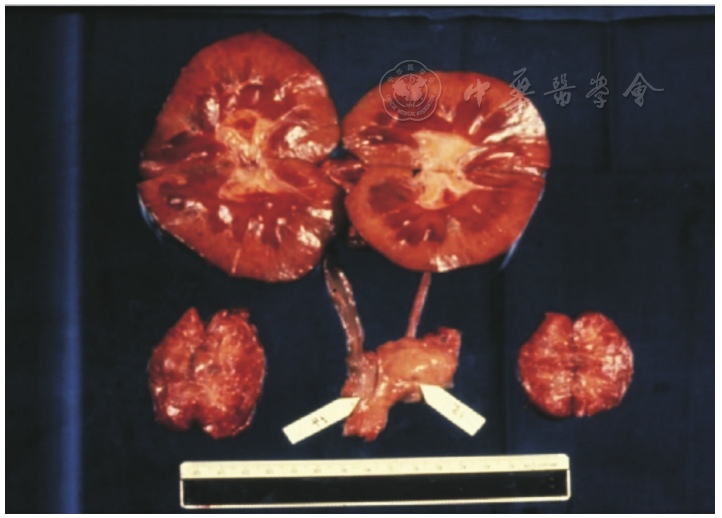
图8
移植后存活9个月的异种移植肾大体标本[]
与此同时,一些外科医生扩大了使用非人灵长类动物作为人肾异种移植供体的来源范围。1963年12月和1964年1月,美国丹佛的托马斯·斯塔兹(Thomas Starzl)和克劳德·赫其库克(Claude Hitchcock)将狒狒的肾脏分别移植给了6位受者。他们选择狒狒肾作为捐献供体的原因是狒狒比黑猩猩更容易获得,也更便宜。这些受者在术后存活了19~98 d,其中1例成功出院,并在异种移植肾遭受排斥反应后,接受了人肾移植来代替无法维持生存的异种移植肾。
1964年,美国里士满弗吉尼亚医学院的大卫·胡姆(David Hume)也将一个黑猩猩的肾脏移植到了一位终末期肾衰竭的受者身上,受者术后每24 h排出54 L尿液,但在第3天死于严重的代谢和电解质紊乱。1965年,法国里昂的居里·特纳格(Jules Traeger)为3例受者移植了黑猩猩的肾脏,受者的最长存活时间为49 d。意大利罗马的拉斐尔·科尔特西尼(Raffaello Cortesini)在1966年将一只黑猩猩的肾脏移植给了一位19岁男性,这名男性最后存活了31 d。上述其他非人灵长类肾异种移植的所有结果与雷姆斯马相似,也都未能获得相对更长的存活时间。
这让研究者们认识到,使用非人灵长类动物肾脏进行异种移植,不仅效果未达预期,而且存在供体数量有限、动物保护和伦理学问题,以及可能导致的疾病传播,特别是逆转录病毒传播的危险性。最终,由于上述因素,使用非人灵长类动物肾脏进行异种移植的研究到20世纪60年代末被完全放弃,再也未见相关报道。
此时,面临异种移植器官供应危机,研究者需要另外寻求器官来源,而猪由于器官体积的大小、功能与人类接近,且对其进行培育改造的经验比较丰富,也不易遭到动物保护组织的反对,从而使其成为了一个很有希望的器官来源。
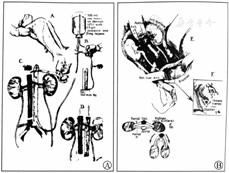
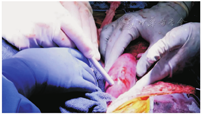
美国阿拉巴马大学伯明翰分校的异种移植项目于2015年启动,该计划的首要目标是推动异种移植以稳健、可持续和符合道德的方式进入临床研究。为了准备异种移植的临床试验,他们开发了一个体内移植的临床前人体模型,以测试在动物模型中建立的安全性和可行性。在进行了一种新颖的、前瞻性的兼容交叉配型后,2021年,他们将一位脑死亡受者的双侧肾切除,并移植了来自一只经过了基因工程改造的猪的2个肾脏(,)。通过再灌注,脑死亡受者的血流动力学稳定,尽管异种移植物暴露于人的血压下,血管的完整性仍保持不变;未观察到超急性排斥反应,肾脏在终止实验74 h前仍有功能;且未发现猪逆转录病毒嵌合或传播。移植肾活检显示,未见血栓性微血管病严重病变,未见细胞排斥反应或抗体或补体蛋白沉积的证据。尽管异种移植肾产生了不同数量的尿液,但肌酐清除率未能恢复。移植肾功能恢复是否受到脑死亡和/或微血管损伤环境的影响尚不清楚。总之,这一研究表明,人类异种移植的超急性排斥障碍可克服,并确定了优化人类异种移植结果需要新的知识()。
点击查看大图
图9
经过基因修饰处理的猪肾植入脑死亡受者术中(来源:UAB News)
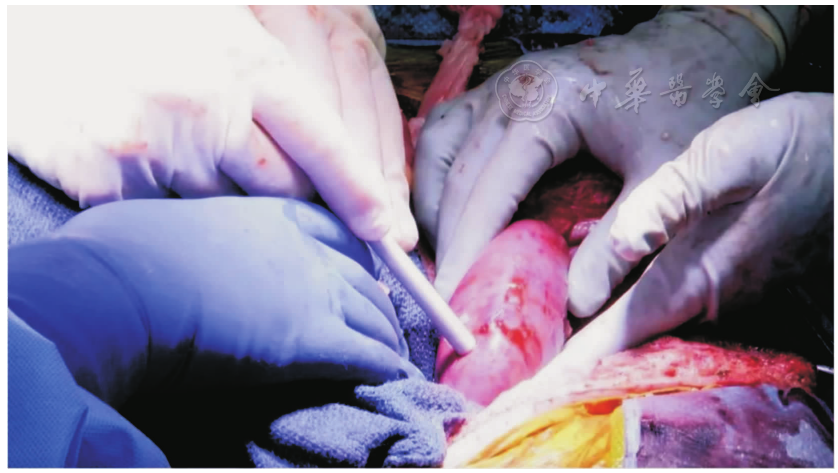
图9
经过基因修饰处理的猪肾植入脑死亡受者术中(来源:UAB News)
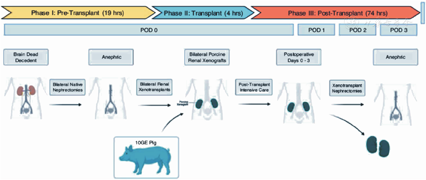
点击查看大图
图10
脑死亡受者-切除双肾-移植转基因猪肾-观察74 h后切除移植猪肾的流程示意图[9]
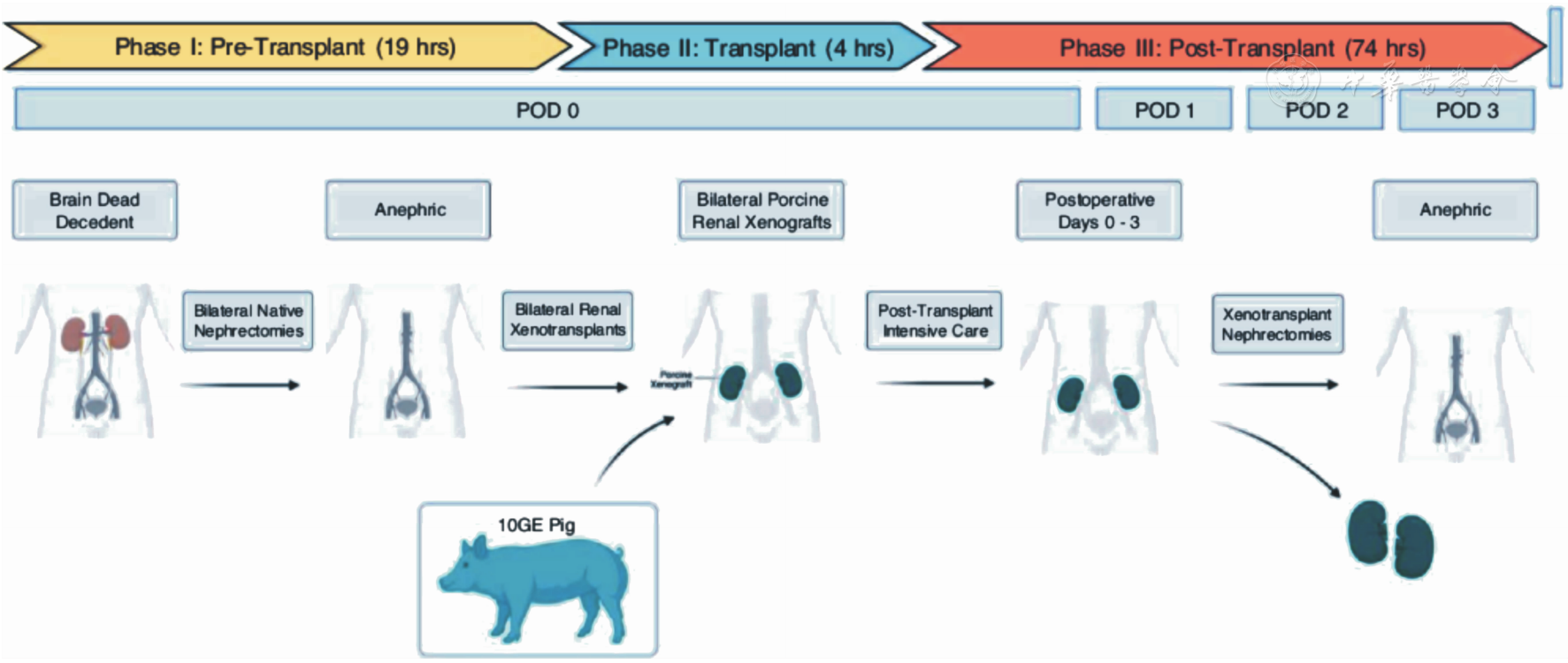
图10
脑死亡受者-切除双肾-移植转基因猪肾-观察74 h后切除移植猪肾的流程示意图[9]

点击查看大图
图11
美国阿拉巴马大学首次猪肾异种移植给脑死亡受者的报告[]

图11
美国阿拉巴马大学首次猪肾异种移植给脑死亡受者的报告[]
用于异种移植的这只基因工程猪肾来自Revivicor公司。转基因猪共有10个基因进行了修饰,包括2个人补体抑制剂基因(hDAF、hCD46)、2个人抗凝血基因(hTBM、hEPCR)、2个免疫调节基因(hCD47、hHO1)的靶向插入以及3个猪碳水化合物抗原和猪生长激素受体基因的缺失(敲除)。更重要的是,这些猪不表达红细胞抗原,因此是血型的通用供体[]。
纽约大学Longone移植研究所也施行了2次转基因猪肾移植给脑死亡受者。第1次猪肾异种移植于2021年9月25日进行,第2次于2021年11月22日进行。整个观察维持脑死亡者的血流动力学稳定。第1次移植冷缺血时间为7 h,第2次为6 h。他们将异种移植肾的动静脉与受者股动、静脉吻合,并将异种移植肾留在体外大腿上方,以便直接观察超急性排斥反应的迹象,并进行连续活检。同时,在异种移植肾输尿管放置导尿管,每小时监测1次移植肾排尿量;在受者膀胱放置Foley导管监测受者自身肾的排尿量。异种移植肾在再灌注后立即呈现粉红色,并在几分钟内开始排尿()。
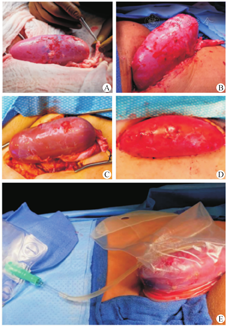
点击查看大图
图12
2例猪肾异种移植受者恢复血供后移植肾外观[] A.受者1恢复血供后;B.受者1移植后54 h;C.受者2恢复血供后;D.受者2移植后54 h;E.移植肾尿引流系统
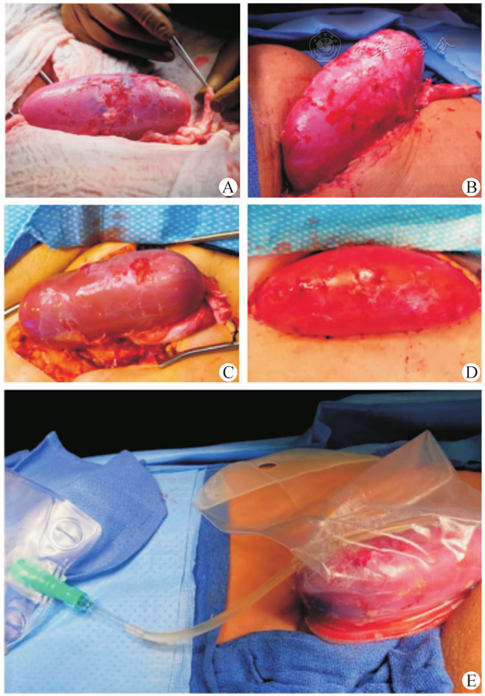
图12
2例猪肾异种移植受者恢复血供后移植肾外观[] A.受者1恢复血供后;B.受者1移植后54 h;C.受者2恢复血供后;D.受者2移植后54 h;E.移植肾尿引流系统
术后免疫抑制包括每日1 000 mg甲基强地松龙和每日2次1 000 mg霉酚酸酯静脉注射,分别给予甘露醇和呋塞米以帮助移植肾利尿。2例受者均接受肝素静脉滴注,并根据全身抗凝的治疗范围进行调整直到移植后54 h终止实验,切取移植肾。
在本次研究中,2例受者术前的血肌酐水平一直处于稳定状态,但移植术后出现下降。其中,受者1从170 μmol/L降到了70 μmol/L,受者2从100 μmol/L降到了50 μmol/L。受者1的动态估算肾小球滤过率(estimated glomerular filtration rate,eGFR)从移植前的23 ml·min-1·1.73 m-2增加到了移植后的62 ml·min-1·1.73 m-2;受者2的eGFR则从肾移植前的55 ml·min-1·1.73 m-2上升到了109 ml·min-1·1.73 m-2。移植肾一直保持粉红色,灌注良好。在整个研究过程中,移植肾每小时排尿量是自身肾的2倍多。在移植术后第6、24、48和54 h进行移植肾活检,均未见超急性或抗体介导的排斥反应的迹象()[]。

点击查看大图
图13
纽约大学Longone移植研究所施行2例转基因猪肾异种移植给脑死亡受者的报告[]

图13
纽约大学Longone移植研究所施行2例转基因猪肾异种移植给脑死亡受者的报告[]
尽管目前以供体猪基因编辑为手段的研究已取得重要突破,使异种移植向临床应用迈出了重要一步,但要达到真正可以用于临床治疗,除需进一步研究预防和克服异种免疫排斥反应的措施外,还面临着异种动物器官与人体器官生理功能的差异问题,这可能是一道更难以解决的难题。此外,人畜共患病问题以及相关的伦理学问题也需要研究和解决。
总之,以猪为供者的异种移植研究对于解决目前的人体器官短缺问题具有重大意义,但异种移植距离临床应用还有很大距离,还有许多困难尚待解决。期望在不远的将来,通过医学和生命科学研究者的不懈探索,异种移植能获得成功。

发表评论