摘要
1962年从水母Aequorea victoria中发现并提取出的绿色荧光蛋白(green fluorescent protein,GFP)以及1999年从珊瑚Discosoma genus中发现的红色荧光蛋白(drFP583)现已成为在生物研究中的各个领域最为广泛的蛋白质之一。由于其具有对生物体无毒无害、受特定波长光激发时可高效发射特征荧光、分子量小、易于构建载体以及在多种生物体中均可表达的特性,在众多领域中展现出了广阔的前景。现已有多种荧光蛋白被应用于实际研究中。
关键词
荧光蛋白,发光机理,发色团,研究历史
1 )荧光蛋白的研究历史
绿色荧光蛋白是第一种被发现的荧光蛋白。1962年,日本科学家下村修从首次从维多利亚多管水母(Aequorea victoria)中发现并分离出了绿色荧光蛋白。起初,绿色荧光蛋白是作为下村修提取水母素的副产物出现。其在阳光下呈现绿色、钨丝下呈黄色强烈,而在紫外光下表现出强烈绿色。通过生物化学的方法和对光谱的研究,下村修初步解析了绿色荧光蛋白的发光机理及发光基团[1]。然而,作为发现者的下村修并没有意识到自己的发现将会在三十年后引起现代生物技术的一场变革。在之后不久,下村修便放弃了对绿色荧光蛋白的进一步研究而选择将研究方向转移至其他的领域。
1985年至1992年间,普拉舍成功完成了绿色荧光蛋白的基因及蛋白质序列的测定,并以此为基础,由道格拉斯·普瑞舍于1992年成功克隆出绿色荧光蛋白的基因。首个将绿色荧光蛋白应用于生物学研究的是哥伦比亚大学的马丁·查尔菲。1994年,通过分子生物学的方法,查尔菲将绿色荧光蛋白的cDNA导入线虫等模式生物并成功使其得到表达,使人们意识到GFP作为报告基因的巨大潜力。同年,钱永健团队成功解析了绿色荧光蛋白的发光机制,并通过突变对GFP进行改造,得到了一些荧光亮度更高、吸收峰单一、构象折叠效率更高的荧光蛋白突变体,如GFP-S65T[2]。
1999年,继绿色荧光蛋白(GFP)之后的第二种类型的荧光蛋白——红色荧光蛋白(drFP583)首次得到报告。这是一种由Matz等人从大平洋地区的珊瑚(Discosoma genus)中提纯出来的一种蛋白质四聚体,在紫外线的照射下可发出红色荧光。由于其具有发射波长长、灵敏度与信噪比较高等优点,为基于GFP的体内研究提供了一个很好的互补工具。但是,drFP583本身具有的缺点、如寡聚化、成熟作用缓慢及对细胞存在毒性等限制了其使用。目前在实际研究中使用较多的是有Clontech公司生产的经过人为改造的低细胞毒性、低寡聚化及快速成熟的突变体E57-NA(商品名为DsRed)。如今,随着DsRed的修饰和改进,其应用领域越来越广,而且它与GFP相结合,为分子生物学和细胞生物学等相关领域的研究提供了一个新的、快捷的检测手段[3]。
2 )荧光蛋白的发光机理
2.1 荧光蛋白的结构
2.1.1绿色荧光蛋白的结构
野生型绿色荧光的一级结构已由对应的cDNA序列推测出来。其一级序列含有238个氨基酸残基,分子量约为27 kDa[2]。根据对制备出的晶体进行的X-光衍射图像分析得知[4],可以得到其二级结构为一个高约为4 nm,直径为3 nm的筒状结构。
圆柱体的筒壁由11条β-折叠环绕折叠而成。β-折叠彼此之间紧密结合,并且形成规则的氢键带。而其中一端则由一个小的α螺旋封闭,使之成为一个一元开口的密集体,称之为β罐。
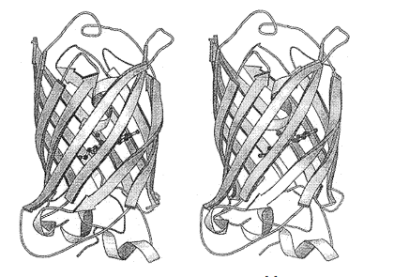
Figure 1.GFP的二级结构[4]
同时,在结构上封闭一端的α螺旋向内延伸至中轴处成为发色团的支架。发色团处于整个结构的核心部位,受到外周β-折叠片层的保护。这样的结构保证了整个构造具有高度稳定性,并且极大程度提高了核心发色团对热、酸、碱以及变性剂等因素的强的抵抗能力[5]。但同时,这样致密的结构也导致了酶或者辅因子难以进去GFP的内部催化发色团的产生。这使得发色团的形成时只能依靠自催化产生。
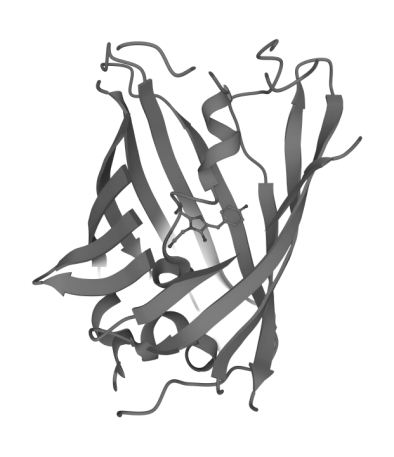
Figure 2.示GFP蛋白发色团与β罐之间结构关系[6]
绿色荧光蛋白的发色团由65-67位的Ser-Tyr-Gly三聚体残基形成。三联体的侧链自动催化环化构成4-(对-羟基苯亚甲基)咪唑-5-啉酮的结构形成GFP的核心发色团。
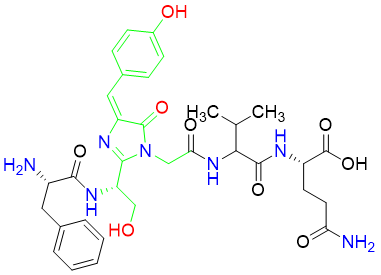
Figure 3.GFP发色团结构(略去其余氨基酸残基)
发色团的形成过程[7]是一个自催化环化的过程,不需要酶或辅因子的参与。在发色团形成时,首先Ser65和Gly67快速环化形成咪唑啉-5-酮中间体,然后由O2缓慢氧化Tyr66的侧链形成一个双键。这一步较为缓慢,往往需要持续数个小时。67位的Gly对于发色团的形成时必须的,没有任何一个氨基酸可以取代Gly67存在。其次,该反应对温度敏感,当反应温度>30 ℃时,反应产率将会下降。这可能与水母自然条件下生活环境的温度较低有关。已生成的生色团本身对热有较强的抵抗力,发色团一旦生产,他就是热稳定的。
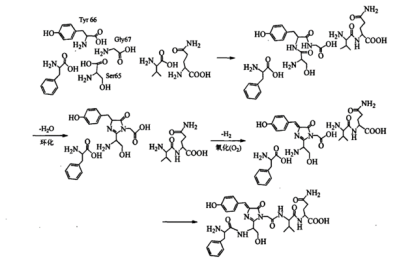
Figure 4 GFP发色团的形成过程[7]
现已经试验证实[7],GFP一级结构的2-232个氨基酸对维持蛋白质的发光特性是必需的。截短C-末端7个以上或N-末端两个以上氨基酸将会导致蛋白质的荧光特性全部丢失。最后七个氨基酸残基无序,不参与构成蛋白的具体结构,因此,在该部分的氨基酸缺失或者额外增添不会对蛋白质整体的功能造成影响;N-末端的氨基酸参与形成了β罐一端的“帽子”结构,对于发色团具有保护作用,是不可缺少的部分,但在N-末端延长肽链并不会破坏蛋白质的结构。但当GFP与某些蛋白组成融合蛋白时,C-末端缺失部分氨基酸残基并不会造成蛋白质荧光特性的缺失,但对光谱特性仍有一定影响[5]。
绿色荧光蛋白在在晶体中或在离子强度低于100mmol/L的溶液中可发生二聚化。二聚化对于自然状态下的GFP与水母荧光蛋白间能量的传递具有促进作用。
2.1.2 红色荧光蛋白(DsRed)的结构
DsRed由225个氨基酸残基构成,相对分子质量约为25.9 KDa。作为一种从珊瑚虫中发现的荧光蛋白质,其一级序列与从维多利亚多管水母中发现的绿色荧光蛋白(GFP)同源性很低,仅为23%左右。但其二者的二级结构具有较高的相似性。同GFP一样,DsRed在二级结构上同样形成了β罐的结构。

Figure 5.DsRed的二级结构(图示为四聚体)[8]
DsRed蛋白的发色团由Gln66-Tyr67-Gly68构成。在结构上与GFP的发色团具有高度的相似性。在发色团的体外成熟过程中,可观测到发色团的最初的激发发射波长为475 nm与499 nm(表现为绿色荧光)。约7个小时之后,绿色荧光强度达到最大,随后便开始衰减。2天后,绿色荧光完全小时,随后红色荧光才开始缓慢产生。经分析,DsRed的发色团形成过程中,需要先形成一个与GFP发色团基本上一致的结构,随后进一步氧化形成DsRed的发色团。与GFP的发色团相比,DsRed的发色团具有一个亚胺的结构[9]。亚胺的双键进一步扩大的发色团的共轭体系范围,使发射波长向长波方向移动。
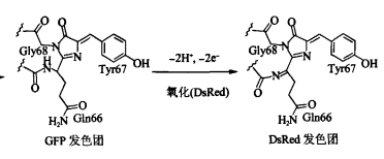
Figure 6.DsRed发色团的形成过程需要经过一个GFP发色团的中间体[9]
晶体学分析得知,DsRed在正常状态下以四聚体的状态存在。并且实验结果表明,DsRed的发色团只有在寡聚化的情况下才能形成及发挥作用。对DsRed碱变性、酸变性及胍变性实验表明,DsRed的发色团要经过几步折叠才可形成,而寡聚化在它的成熟过程中起重要的作用[3]。
2.2 荧光蛋白的发光机理
现有研究已证实,目前所发现的荧光蛋白的发光机理大同小异。GFP作为最早被发现并研究的荧光蛋白,关于其发光机理方面的研究已趋于完善。因此,此部分主要论述GFP的荧光发生机理。
在维多利亚多管水母体内中,荧光蛋白的荧光产生是与另一种发光蛋白—水母发光蛋白相互耦联作用。
水母荧光蛋白以水母荧光素为辅基,在钙离子作用下可以发出460-470 nm蓝光。
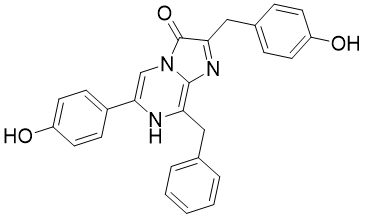
Figure 7 水母荧光素
Figure 8 水母发光蛋白(Aequorin)[10]
水母荧光蛋白在钙离子存在时,受氧气氧化释放出的蓝光经FÖrster循环将能量传递给GFP的发色团,随后GFP的发色团受激发释放出绿色荧光蛋白特有的绿色荧光(509 nm)。
现在一般认为,GFP的荧光产生是经过一个称为ESPT(激发态质子转移)[11]的过程,其荧光产生的核心在于发色团中的Tyr66的支链酚部。由于酚具有微弱的酸性,存在中性状态与离子状态的互变,并且在一般情况下,中性状态是优势构象,二者以大概6:1的比例存在。但当发色团
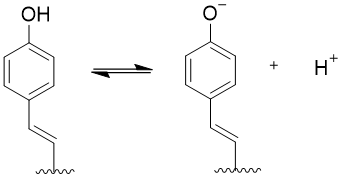
Figure 9 发色团酚基团中性状态与离子状态的互变
受光激发时,基团的酸性将会大幅增加,发色团周围的微环境中氨基酸残基侧链基团之间以及氨基酸残基侧链与水分子之间共同组成的氢键网络的变化在这个过程中起到了决定性的作用[12]。
晶体学的分析显示,在非激发状态下,Tyr66酚羟基呈中性状态,Glu222羧基的静电斥力和与被束缚的水分子Wat304、Ser205侧链氧之间形成的氢键共同维持这一种状态。Glu222与Ser65之间的状态可对这一种状态进行进一步稳定。
当进入激发态时,由Glu222通过与Wat304和Ser205构成的氢键网络向发色团酚羟基传递一个负电荷,酚羟基的质子同时传递出去。大部分情况下,接受电荷的发色团将发生光异构化,随后释放出504 nm的辐射会回到基态并重新转变为中性状态。
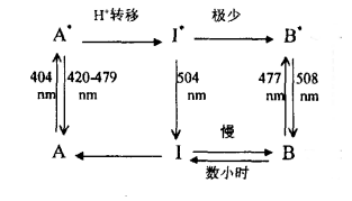
Figure 10.GFP的发光机制模型[12]
但在少数情况下,通过氢键网络的变化将会将发色团稳定在离子态。His148侧链与Tyr66酚氧(Oη)之间形成的氢键、Wat304和Tyr66 Oη以及Thr203侧链氧、Ser205的侧链氧将会形成新的氢键网络以稳定发色团的状态。同时,Glu222和Ser205之间的氢键发生断裂,Glu222的羧基氧也可能会发生顺反异构化。
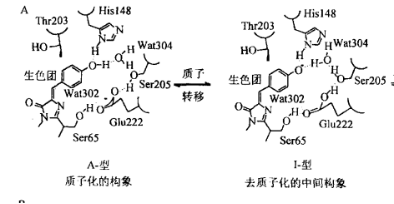
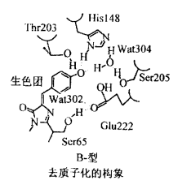
Figure 11 GFP不同状态下生色团的构象[12]
3 )荧光蛋白的改造
野生型的荧光蛋白具有发光强度低、折叠易受温度影响、产生荧光具有滞后性以及具有细胞毒性(drFP583)等缺陷,因此目前人们使用的荧光蛋白大多经过改造。对于荧光蛋白的改造一般围绕发色团来展开。其基本思路分两类:一是直接对发色基的进行化学修饰从而直接影响发色团的光化学性质;二是通过对构成发色团周围微环境的氨基酸进行替换通过微环境的改变进而影响发色团的荧光性质。这里简单介绍几种常见的改造后荧光蛋白[11]。
3.1 增强型蓝色荧光蛋白(EBFP)
将野生型的GFP的Tyr66替换为His,使用咪唑基取代原本的酚基。这一突变使得激发与发射光谱相对于原本GFP发生蓝移(激发波长:383 nm,发射波长:445 nm)。并且将Val150突变为Lle、Val224突变为Arg以填补组氨酸替换酪氨酸留下的空洞,增强发光基团的稳定性。
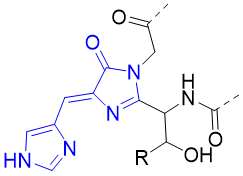
Figure 12.EBFP发色团结构
3.2 增强型青色荧光蛋白(ECFP)
青色荧光蛋白的产生与蓝色荧光蛋白在改造思路上一致,将Tyr66的酪氨酸改造为色氨酸将会在发色基中引入一个吲哚。此时发色团的的激发波长与发射波长进入到野生型GFP的中性酚状态下与离子酚状态下的激发波长与发射波长之间,呈现出蓝绿色的特征荧光(Ex:439 nm,Em:476 nm)。此外,使用天冬氨酸取代His148以消除Tyr145与His148之间的交换,稳定蛋白的第一构象状态。若进一步将Tyr145替换为Ala则有利于增强突变体的荧光强度。S72A突变在加速发色团的成熟方面有重要作用。
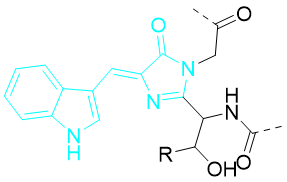
Figure 13.ECFP发色团结构
3.3 增强型黄色荧光蛋白(EYFP)
EYFP的产生主要依赖于对野生型GFP的发色团周围微环境的改造。相对于avGFP,最大的突变在于使用酪氨酸取代了Thr203。当荧光蛋白折叠时,Tyr203的酚基将会伸入到荧光蛋白内部的空腔,并且与发色团的酚基团在空间上形成了π-π叠加相互作用。这种突变稳定了发色团的激发态偶极矩,从而使得GFP的吸收光谱和发射光谱整体向长波方向平移约20 nm左右。另外Gln69向Lys的突变增强了发色基的离子化,将发射波长向长波方向进一步移动了1-2 nm。
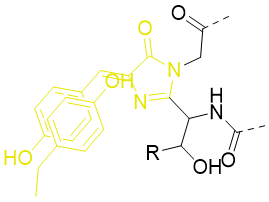
Figure 14.EYFP发色团结构
3.4 Superfolder GFP
SuperfolderGFP整合了9个点突变:S30R、Y39N、F99S、N105T、Y145F、M153T、V163A、I171V以及A260V。相比于野生型的GFP,Superfolder GFP具有更好的稳定性及更高效的折叠动力学(能在37 ℃条件下高效折叠),亮度也比EGFP要高,同时表现出相比与GFP家族其他成员更强的抗酸碱性。
3.5 橙色荧光蛋白(mOrange)
mOrange是mFruit荧光蛋白家族的成员之一,其特征吸收与发生光谱分别为548nm与562 nm。mFruit家族作为DsRed红色荧光蛋白改造后产物,相对而言具有不寡聚化、毒性低、亮度高、成熟快等优点。mOrange的橙色荧光是由于发色团在形成时在Thr66处形成了恶唑环而产生。恶唑环的形成降低了65位的羰基的共轭,从而导致了吸收光谱与发射光谱相对于野生型的蓝移现象。
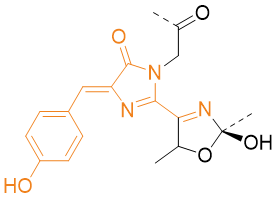
Figure 15.mOrange发色团结构
4)评述
从最初发现的种类单一的绿色荧光蛋白,到如今多种多样具有多种不同光谱特性的荧光蛋白可供生物工作者选择,荧光蛋白在某种定义下可以说是革新了生物学研究,为生命科学研究提供了极为有效的方法,具有划时代的意义。荧光蛋白作为一种新型的优良标记物,已广泛应用于生物学的各个领域。相信对荧光蛋白研究的进一步深入,必将为其应用开辟更广阔的前景。
主要参考文献
[1] 朱 昀,李朝炜.绿色荧光蛋白[J].生物学教学,2010,35(6):62.
[2] 王裕鹏.讲述荧光蛋白[J].生物学教学,2019,44(5):73-74.
[3] 郝丽梅,李唐棣.红色荧光蛋白的研究进展[J].国外医学药学分册,2006,33(2):131-133.
[4] 刘默芳,王恩多.绿色荧光蛋白[J].生物化学与生物物理进展,2000,27(3):238-243.
[5] 刘祖强,胡 敏,齐义鹏.绿色荧光蛋白的结构、发光机制及其应用研究[J].武汉大学学报,2000,46(2):211-214

发表评论