
2023年欧洲肿瘤内科学会(ESMO)年会已在西班牙落幕,肺癌围术期的研究迎来了诸多新进展。CheckMate 816研究(摘要号1261O),研究者公布了PD-1抑制剂联合CTLA-4抑制剂(双免疫治疗)对比化疗的疗效、安全性和手术结局的探索性分析。

CheckMate 816研究达到了两个主要终点,在可切除的非小细胞肺癌(NSCLC)患者中,与单用化疗相比,新辅助免疫联合化疗在无事件生存期(EFS)和病理完全缓解(pCR)方面显示出统计学和临床意义的改善,并表现出长期的EFS获益。本次大会报告了CheckMate 816研究的探索性分析结果。
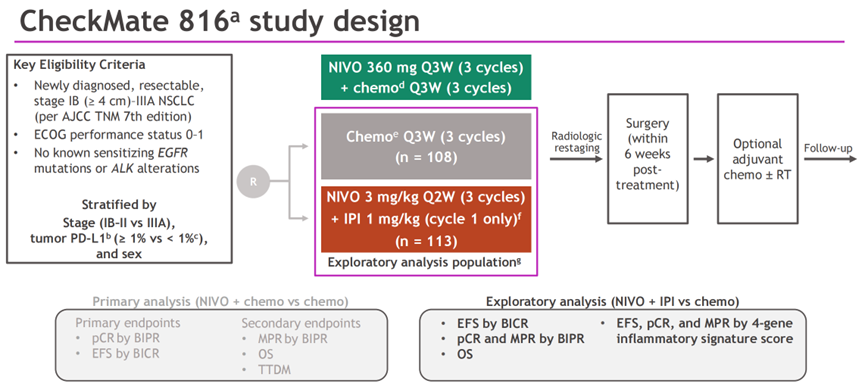
图1. CheckMate 816研究设计
研究纳入可切除的IB期(≥4cm)-IIIA期(AJCC第7版),ECOG PS≤1,无已知EGFR/ALK突变的成人NSCLC患者,试验组接受双免疫联合治疗3个周期(CTLA-4抑制剂仅1个周期)。随着免疫联合化疗组获得出色的结果后,双免疫联合组的招募提前结束。
探索性分析,评估包括EFS和pCR(根据盲法独立中心审查)、总生存期(OS)、手术结果、安全性以及根据基线肿瘤样本RNA测序得出的4基因[CD8A、STAT1、LAG3和CD274(PD-L1)]炎症特征评分得出的疗效。
中位随访时间为49.2个月,EFS和OS都更倾向于双免治疗组获益。双免疫治疗和化疗组的中位EFS分别为54.8个月和20.9个月(HR=0.77;95%CI:0.51-1.15);3年EFS率分别为56%和44%。双免疫组的pCR率高于化疗组,分别为20.4%和4.6%。双免疫组的MPR率高于化疗组,分别为28.3%和14.8%。两组中位OS均未达到(HR=0.73;95%CI:0.47-1.14),3年OS率分别为73%和61%。两组最终的手术率分别为74%和76%;R0切除率分别为80%和71%。
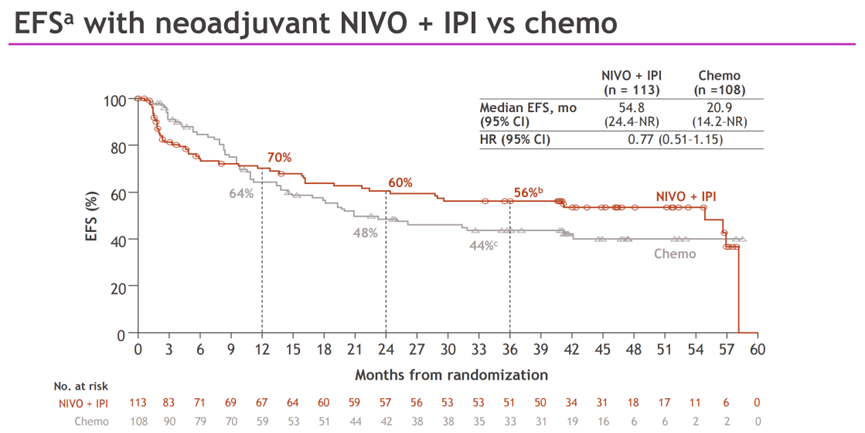
图2.研究EFS数据
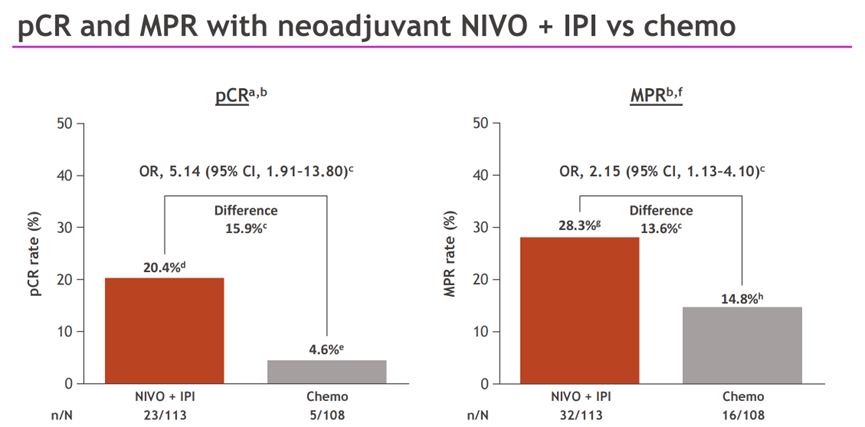
图3.研究pCR和MPR数据
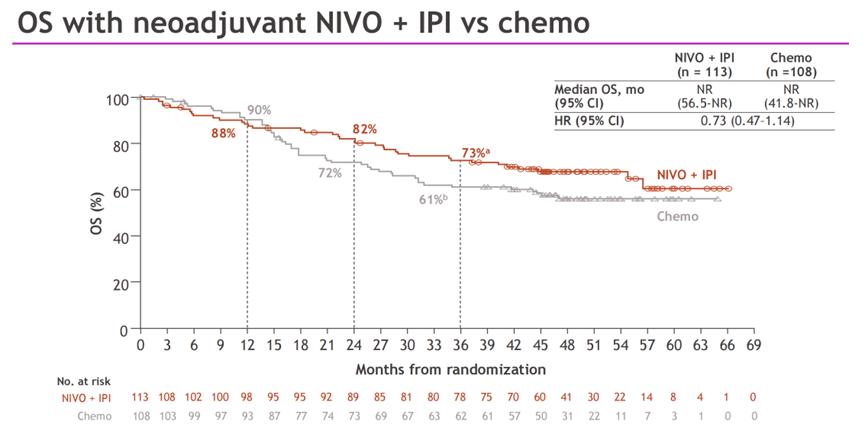
图4.研究OS数据
两组中分别有14%和36%的患者报告了3-4级治疗相关不良事件(TRAEs),分别有15%和14%的患者报告了3-4级手术相关AEs。
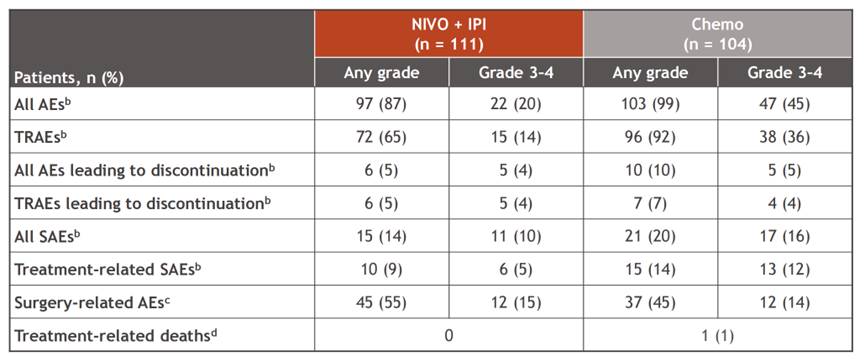
图5.研究安全性数据
CheckMate 816研究的这项探索性分析表明,与化疗相比,新辅助双免疫治疗在可切除 NSCLC 患者中显示出潜在的临床获益与可耐受的安全性。
中国利量 全新PD-L1阿得贝利单抗围术期NSCLC免疫治疗取得新突破
由广东省人民医院吴一龙教授牵头的采用恒瑞医药自主研发的全新一代PD-L1抑制剂阿得贝利单抗联合化疗作为可切除的II-IIIB期NSCLC围手术期治疗的Ib/III期临床研究(SHR-1316-III-303研究),Ib期研究结果于2023年2月重磅公布,全文在线发表于胸部肿瘤领域权威期刊Journal of Thoracic Oncology(JTO)。本次公布的Ib期结果,受到JTO杂志编辑的高度评价,认为该研究是迄今为止,NSCLC围术期治疗领域中,在手术结果方面提供最全面、最完整数据的一项研究。详细统计了接受阿得贝利单抗联合化疗新辅助治疗的患者能否手术、何种术式以及疗效指标等数据,为我国NSCLC领域免疫新辅助治疗的探索提供重要指导与参考。
从手术结局看,接受阿得贝利单抗新辅助治疗的患者手术切除率高达91.9%,高于CheckMate-77T研究中纳武利尤单抗联合化疗的80%手术切除率。其中,94.1%的手术切除患者达到R0切除,73.1%的患者实现淋巴结降期,提示着更低的长期复发风险和更长的生存时间,为局晚期患者带来福音。在手术方式选择上,相较于CheckMate 816研究,接受阿得贝利单抗联合化疗新辅助治疗的患者具有更高的微创手术率(61.8% vs 29.5%)和更低的全肺切除术率(5.9% vs 16.8%)。
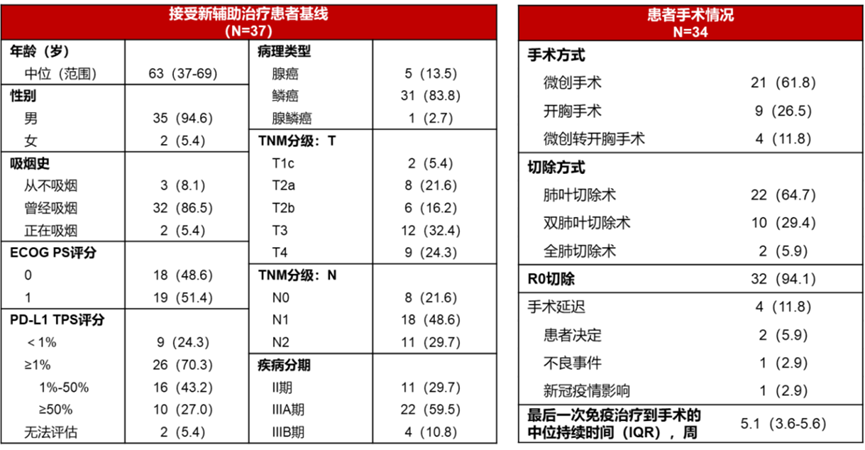
图6. 阿得贝利单抗联合化疗新辅助治疗患者基线及手术情况
研究结果显示,阿得贝利单抗联合化疗新辅助治疗后接受手术患者当中,主要病理缓解(MPR)率为51.4%,病理完全缓解(pCR)率高达29.7%。12个月的EFS率为77.8%,同样为广大NSCLC患者带来显著的生存获益。
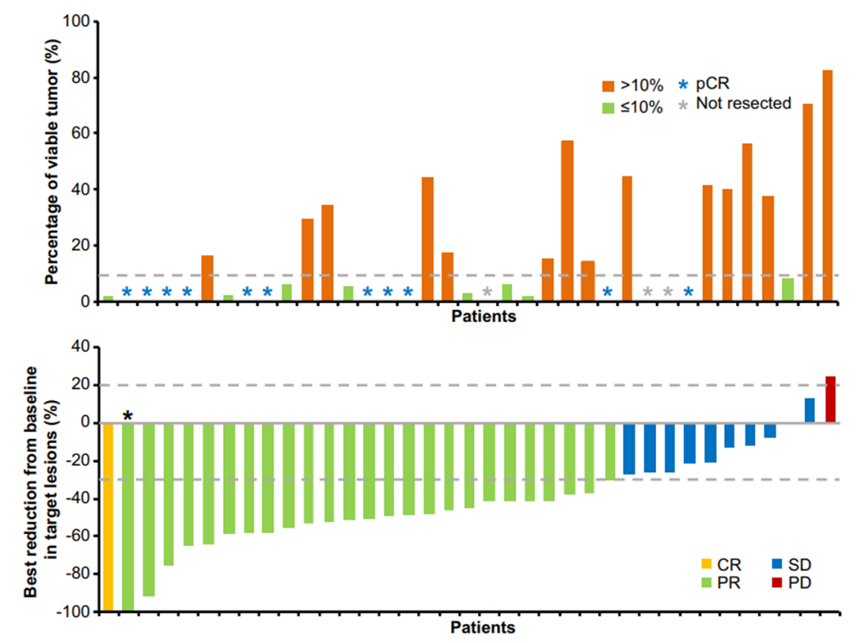
图7.研究病理缓解情况
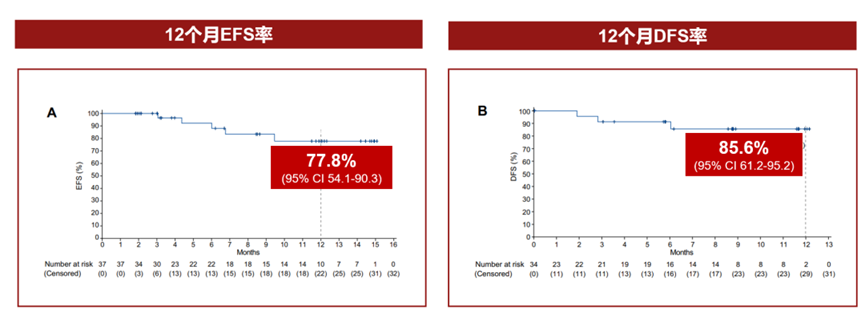
图8.研究EFS和DFS数据
安全性方面,本项研究入组患者100%完成新辅助治疗,耐受性良好,未发现新的安全信号,不良反应类型与阿得贝利单抗联合化疗一线治疗广泛期小细胞肺癌的III期CAPSTONE-1研究中结果一致,主要为化疗相关的血液学毒性。无治疗相关的死亡发生。免疫相关不良反应(irAEs)发生率为24.3%,最常见的irAE为皮疹,发生率为8%(3/37),仅1例患者发生≥3级irAE(皮肤脓疱疹)。
基于该Ib期研究的结果,III期随机、双盲、安慰剂对照临床研究SHR-1316-III-303研究正在进行中。
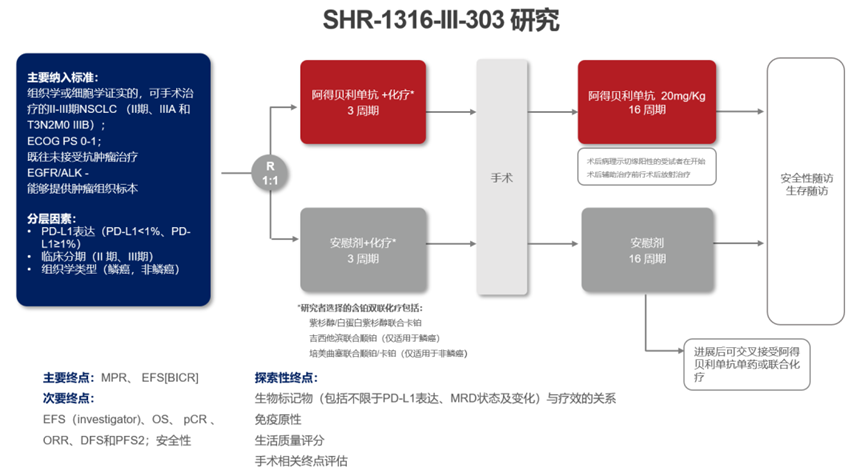
图9. SHR-1316-III-303研究设计
精挑细琢 抗体功能更纯净 广泛期小细胞肺癌安全优选
阿得贝利单抗是由恒瑞公司研发的全新一代PD-L1免疫检查点抑制剂,于2023年2月28日获批上市,成为首个获批SCLC一线治疗的中国原研PD-L1抑制剂。从源头上创新,打破了进口PD-L1的垄断。
首先,阿得贝利单抗选择了IgG4抗体类型。同类进口PD-L1抑制剂都选择的是IgG1抗体类型,但阿得贝利单抗在抗体研发立项时,就非常明确地希望筛选得到一款抗体功能更加纯净、高亲和力、并专注于阻断PD-L1/PD-1信号通路的免疫检查点抑制剂。IgG4抗体类型相比IgG1,天然没有补体依赖的细胞毒性作用(CDC),且抗体依赖性细胞介导的细胞毒性作用(ADCC)、吞噬作用(ADCP)和细胞因子释放(ADCR)效应皆较弱。ADCR效应的降低,一方面可以减少IL-8的释放,增强免疫疗效,另一方面可以减少IL-6的释放,减少免疫相关不良反应的发生。
其次,阿得贝利单抗进行了独特的234A/235A改造。PD-L1不仅仅表达在肿瘤细胞上,在T细胞,树突细胞,巨噬细胞等表面均有表达。因此,具有ADCC、ADCP等Fc段功能的抗体也会误伤免疫细胞导致不可控的不良反应发生和疗效损失。为此,阿得贝利单抗又进行了Fc段的234A/235A改造,去除了ADCC、ADCR效应,降低了ADCR效应,安全性大大提高。
最后,从分子结构角度看,相比于既往上市的PD-L1抗体,阿得贝利单抗具有独特的与PD-L1的结合表位,其结合的角度更加居中,结合区域与结合面积更接近天然PD-1受体。同时阿得贝利单抗与PD-L1结合的解离常数Kd值仅为0.27*10-10mol/L,亲和力相较于已上市的PD-L1抗体更强。
抗体改造后阿得贝利单抗的疗效和安全性在III期研究CAPSTONE-1中得到证实,研究结果显示,阿得贝利单抗联合化疗相较于对照组显著改善了患者的总生存期(mOS: 15.3个月vs 12.8个月),HR=0.72,降低28%的死亡风险。值得一提的是,CAPSTONE-1研究中对照组有73.7%患者积极接受了后线治疗(包括抗血管生成治疗、免疫治疗等),在对照组如此高比例接受后线治疗的情况下,阿得贝利单抗联合化疗组仍然取得显著生存获益,更体现了阿得贝利单抗的卓越疗效,也印证了一线应用免疫治疗的重要性。其次,阿得贝利单抗联合化疗组2年生存率达31.3%(vs化疗17.2%),这意味着约1/3的患者生存期超过2年,是对照组的近2倍。这一卓越的结果彰显了中国研究者、民族药企的研究实力。同时,研究中阿得贝利单抗的安全性良好,≥3级的irAE发生率均不超过1.8%,irAEs发生率相较于对照组仅提升10.6%,优于同类III期研究。
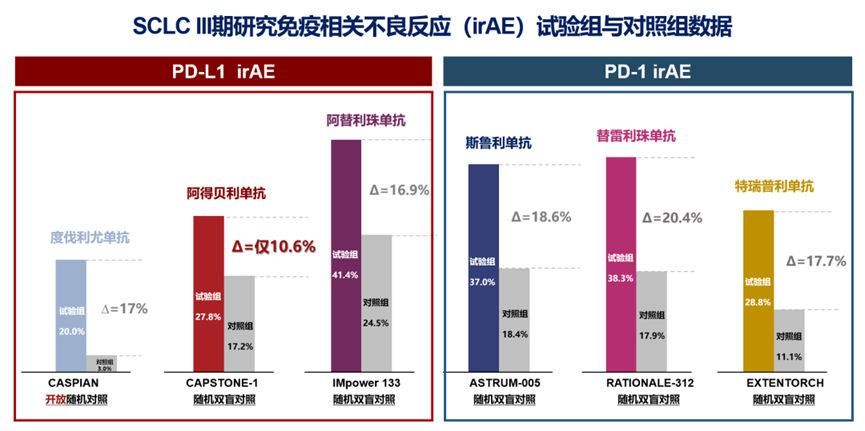
图10. SCLC III期研究免疫相关不良反应(irAE)试验组与对照组数据
基于CAPSTONE-1研究的卓越研究数据,由恒瑞医药自主研发的全新一代PD-L1抑制剂阿得贝利单抗一经上市,即先后纳入《CSCO小细胞肺癌诊疗指南(2023)》I级优选推荐(1A类证据)与《中华医学会肺癌临床诊疗指南(2023版)》1类推荐证据。期待疗效可靠,安全无忧的阿得贝利单抗,惠及更多中国肿瘤患者。
参考文献
1.2023 ESMO 1261O
2.Yan W, et al. J Thorac Oncol. 2023 Feb;18(2):194-203.
3.Wang J, Zhou C, Yao W, et al. The Lancet Oncology. 2022 Jun;23(6):739-747
4.Vidarsson, et al. frontiers in immunology, 2014 Oct 20;5:520
5.Liu R, et al. Antibodies (Basel). 2020 Nov 17;9(4):64.
6.HornL,etal.,NEnglJMed,2018;379:2220-2229.
7.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)小细胞肺癌诊疗指南-2023[M]. 北京:人民卫生出版社,2023.
8.中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2023版)[J]. 中华医学杂志, 2023, 103(27): 2037-2074.


发表评论