
以史探理--以“空气成分的探究”教学为例
一.教材分析
《空气》是(浙教版)教科书《科学》八年级下册空气与生命单元的第一节课。
本节教材主要介绍了空气的成分与空气的利用两部分内容。上承八年级上册的地球的“外衣”——大气等知识,下接本单元的氧气和氧化、空气污染与保护以及第三单元植物与土壤等知识,对于以前的知识是一种补充和完善,对于以后的知识则起着铺垫的作用,是知识逐步向能力转换的一座桥梁。
二、学情分析
1.学生已有知识
学生由小学常识课和第二、三册《科学》的学习知道空气里主要有氮气和氧气,还有二氧化碳,水蒸气等成分,但不了解各成分具体含量,未接触过化学定量分析方法;对物质组成和性质的理解较为模糊。对氧气能供人呼吸和支持燃烧等知识,也已经有一定的了解和掌握。
2.学生已有方法基础
学生对运用科学试验探究自然规律的方法有一定的认识,学习过如何求质量分数,已经初步学会进行科学猜想,并知道这是一种良好的认知方法。
3.学生能力分析
初二阶段的学生已有较强的独立思维能力,他们喜欢讨论问题发生的原因,并能够在已有知识的基础上发挥想象,对身边的一些现象做出解释和推测。
学生的这些特点为本节课的教法和学法提供了理论基础。
三、教学目标
1.科学观念
了解空气的主要成分,了解组成空气各主要成分的体积分数;了解空气的利用。
2.科学思维
初步学习运用观察、比较、分析、归纳等方法对信息进行加工的科学方法。
3.探究实践
能根据实验现象分析空气的主要成分及空气中氧气的体积分数;能根据已有知识发挥合理的想象。
4.态度责任:
重温科学家发现空气成分的过程,体会科学家的研究思想、方法和科学态度;
初步养成严谨求实、敢于质疑和勤于思考等科学品质;初步建立科学的物质观,认识到科学是不断发展、完善的过程。
四、教材重点、难点
重点:空气的主要成分,各主要成分的体积分数,空气的利用。
难点:通过实验得出空气中氧气的体积分数。
五、教学过程
一、情境引入
师:去年5月4号,我国13名珠峰科考队员成功登顶珠穆朗玛峰,并成功测量峰顶冰雪厚度,这在我国科考史上具有划时代的意义。我们先来看一段视频:
师:为什么科考队员要背着笨重的氧气瓶吸氧而不直接吸空气呢?空气中不是也有氧气吗?
生:空气中还有其他气体;空气中的氧气含量不高。
师:那空气中的氧气含量是多少呢?
生:约占五分之一(21%)
师:空气中除了氧气,还有哪些成分呢?
生:水蒸气,氮气,二氧化碳,稀有气体等;
过渡:同学们,现在我们都知道空气是由多种物质组成的混合物,那古人是怎么认为的呢?他们又是如何一步步发现空气中的各种成分的呢?接下来就让我们一起重温空气成分的发现之旅。
二、空气的成分发现的科学史
(一)古人的空气观
一直以来,人们对空气充满着好奇。古希腊哲学家亚里士多德就曾提出“四元素说”,认为水、火、土、气是组成这个世界的基本元素。中国古代的“五行说” (水、火、土、气 、木 );但在18世纪中叶以前,人们坚信空气是单一的“元素”,是一种纯净物。尽管在这期间人们发现除了寻常的空气,似乎还有一些“特殊的空气”。
(二)海尔蒙特和二氧化碳
17世纪初,比利时化学家范·海尔蒙特发现木炭燃烧后有灰烬产生,还有不能保存在容器中也不可见的物质产生。他命名为gas sylvestris(森林之精),并通过实验证明这种气体不助燃,烛火在其中会熄灭。
师:同学们,你们认为gas sylvestris(森林之精)可能是什么气体呢?
生:二氧化碳;
师:你猜测的依据是什么?
生:它是木炭燃烧后的产物,而且这种气体不助燃,烛火在其中会熄灭。
师:“森林之精”确实就是二氧化碳。同学们,你们可以证明空气中有二氧化碳吗?(提示:二氧化碳能让石灰水变浑浊)
生:向盛有二氧化碳的试管中吹气,观察石灰水是否变浑浊。
师:该实验一定能证明空气中含有二氧化碳吗?
生:不一定。只能证明人体呼出的气体中含有二氧化碳。可能空气吸入人体后发生了化学变化(成分发生了变化)。
师:那怎样才能证明空气中含有二氧化碳?
分组实验:每组取2支试管,分别装入等量的澄清石灰水,一只用打气球的打气筒缓慢往试管里打气,另一只作为对照,观察、比较、分析实验现象。
结论:空气中有二氧化碳,但含量很少。
(三)“脱燃素空气”和“火空气”(1773年)
随着对燃烧现象的深入研究,英国化学家普利斯特利和瑞典化学家舍勒先后用不同方法制得了氧气,并分别将其命名为“脱燃素空气”和“火空气”。(播放视频)
(四)拉瓦锡实验(1774年)
后来,法国化学家拉瓦锡在听说了普利斯特利从氧化汞中制取氧气(当时称之为脱燃素空气)的方法后,就做了一个著名的研究空气成分的实验。

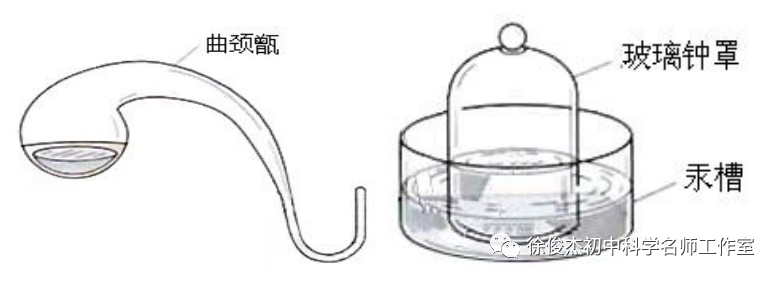
师:整个装置结构比较复杂,我们可以进行简化分析。这个脖子很长的玻璃瓶叫做曲颈甑,他那弯曲的脖子可以被汞槽和玻璃钟罩密封起来。曲颈甑里面放少量的水银,可以消耗装置内的氧气。
师:该装置中,我们比较熟悉的火炉它有什么作用?
生:加热
师:给什么物质加热?
生:汞
师:为什么要加热?
因为汞和氧气反应生成氧化汞
师:汞的作用是?
消耗氧气
师:氧气消耗后,汞槽内会发生什么变化?
液面上升
师:液面为什么会上升?
氧气消耗后,钟罩内的气压减小,大气压将汞压上去。
师:上升的汞的体积和消耗的氧气的体积有什么关系?
生:上升的汞的体积就等于消耗的氧气的体积
教师演示实验:发现用注射器抽掉的空气的体积和进入的水的体积基本相等。
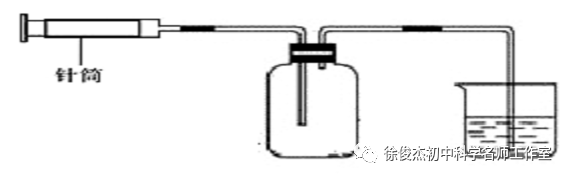
师:也就是说拉瓦锡是通过汞消耗氧气,汞槽内汞上升的体积来测量内部空气中氧气的体积。
拉瓦锡当时做这个实验用了12天。
师:我们今天如果在课堂上通过该实验来测氧气的含量合适吗?
不合适,该实验的时间过长。
师;如何改进呢?
改变消耗氧气的物质、重新选择材料(展示五个化学方程式)

思考一下,你可以选择什么物质来替代汞?
红磷
师:你为什么不选择碳?
生:碳和氧气反应生成二氧化碳气体,压强几乎不变
师:你为什么不选择铁?
生:因为铁粉反应比较慢
师:为什么不选镁来消耗氧气,镁的反应速度也很快?
生:镁除了会消耗氧气,还会消耗氮气。导致所测氧气体积偏大。
学生归纳选择化学药品的三大原则:
1.生成物不能是气体;
2.药品能快速消耗氧气;
3. 只能跟空气中氧气反应。
接下来,我们就用红磷来测空气中氧气的含量。红磷燃烧是要放在如图所示的燃烧匙中点燃的,同学们请看图。我们该如何测量空气中氧气的体积呢?

加根玻璃导管,反应结束后,大气压将水压入集气瓶中,通过压入瓶中水的体积来反映氧气的体积。
如果要准确测量出氧气的体积怎么办?
可以将烧杯换成量筒
还需要测量什么量?
空气的体积
怎么测?可以将瓶中装满水,然后将水倒入量筒中,量筒中水的体积即为空气的体积。
因为红磷燃烧过程中可能会有溅落,反应后会生成一些有毒物质,可以在瓶中留一小部分水进行保护和吸收。
先测一下瓶中空气的体积,多少?250ml,量筒中水的体积为100ml。
下面老师来做一下实验,注意观察现象。
什么现象?红磷剧烈燃烧,产生黄色火焰,生成大量的白烟。
反应结束后立即打开止水夹吗?
待冷却后
打开止水夹,读出量筒中水的体积为50ml
计算得到氧气的体积分数为20%
其实,科学家也通过的多种实验方法,测量出氧气的体积分数约为21%
老师这里也有一个氧气传感器,我们来测一下,也是21%
为什么我们测出来的却是20%?
实验有误差。请大家讨论一下。
分析偏大和偏小的原因,偏低原因:
(1)红磷的量不足;
(2)瓶内氧气没有耗尽;
(3)装置漏气(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙等),使外界空气进入瓶内;
(4)未冷却至室温就打开弹簧夹,使进入瓶内的水的体积减少。
偏大原因:(1)点燃红磷后,插入燃烧匙时,瓶塞子塞得太慢,使得瓶中空气受热膨胀,部分空气溢出。
师:此实验说明剩余气体有哪些性质(至少两点)。
生:①不燃烧也不支持燃烧 ②不溶于水
师:拉瓦锡研究了剩余的那部分空气,由于剩余的气体不助燃、无助于生命,他误认为剩下的这些气体是同一种气体,并将其命名为“氮”,意思是“不能维持生命”。
(五)雷利实验。(1892年)
拉瓦锡之后相当长的时间内,科学家认为空气中不会再含有其他成分了。直到1892年英国物理学家雷利发现从含氮的化合物中制得的氮气每升重1.2505g,而从空气中分离出来的氮气在相同情况下每升重1.2572g。虽然两者之差只有0.0067克/升,但却引起了雷利的注意。
师:如果你是当时的雷利,你会作何猜想?
生:空气中的氮气中一定含有尚未被发现的较重的气体。
师:雷利沿用卡文迪许的放电方法从空气中除去氧和氮;英国化学家拉姆塞把已经除掉CO2、H2O和O2的空气通过灼热的镁以吸收其中的氮气,他们二人的实验都得到一些残余的气体,经过多方面试验断定它是一种极不活泼的新元素,定名为“氩”,原文是不活动的意思。随后,拉姆赛又陆续发现了氦、氪、氙、氖 和氡等,统称为稀有气体。
师:科学家给他们取名叫稀有气体,又叫惰性气体,说明这些气体具有什么特征?
生:说明该气体特别的稀少,特别不活泼

空气中还有别的气体吗?
水蒸气
如何证明
师:我今天带来的不是饮料,而是冰,(把冰放入烧杯内)同学说烧杯外壁有小液滴,把看不到的转化成看得到物质,有小液滴就是水吗?有没有进一步方法来证明。其实证明水的方法有很多,一种是无水硫酸铜颜色由白变成蓝色,还有用蓝色氯化钴试纸变红。科学上经常把看不见现象转化成看到并看到明显的现象。
演示实验 现象(等会观察)
小结:科学家通过大量的实验,得到的空气的主要成分及其含量。


发表评论