
自噬研究的历史
自噬autophagy一词源自希腊语,在1963年由比利时生物化学家德迪夫(C. de Duve)针对在细胞中观察到的自噬现象而命名。希腊语里,auto-意为自己,phagein意为吃掉,中文译为自噬。自噬是指细胞对不必要或受损的细胞器进行吞噬、降解及再利用的过程,自噬过程既能发生在各种极端情况下以确保细胞存活,也存在于细胞的正常状态下,以维持细胞的稳态平衡。
自噬现象最初由洛克菲勒研究所(Rockefeller Institute)的波特(K. R. Porter)和他的学生阿什福德(T. Ashford)于1962年报道,当时他们观察到胰高血糖素刺激后,大鼠肝细胞中的溶酶体(lysosomes)增加,更有意思的是,在移动到细胞中心的一些溶酶体中检测到来自其他细胞器如线粒体的成分。当时他们错误地以为这个现象只是溶酶体的形成过程,并不认为溶酶体是像线粒体一样存在于细胞质中的细胞器,且将观察到的水解酶理解为是由微体产生的。1963年,赫鲁班(Z. Hruban)等报道了局部细胞质降解的超微结构,该报道参考了1955年德国科学家的损伤诱导融合模型,观察到了从细胞质融合到生成溶酶体的三个连续步骤,并提出这个过程不仅由损伤阶段诱发,而且在细胞分化的生理阶段,同样的过程也在“细胞器处置”和“细胞成分再利用”中行使功能。这篇报道引起了当时也在洛克菲勒研究所工作的德迪夫的兴趣,与之前波特的看法不同,德迪夫把这种现象命名为自噬(autophagy),并提出在胰高血糖素引发的肝细胞降解过程中溶酶体发挥了功能。1967年德迪夫连续发表两篇文章证实胰高血糖素诱发的自噬是由溶酶体介导的,他也由此成为第一位报道溶酶体参与细胞内自噬的科学家[1]。1974年德迪夫因发现细胞内结构及功能性器官(溶酶体和过氧物酶体),与另外两位科学家共享了该年度的诺贝尔生理学或医学奖。
尽管自噬现象的命名人德迪夫成为诺奖获得者,但在大隅良典开始他的酵母模型试验之前,自噬并未得到生物学家的特别关注,因而几乎没有研究者再对其进行深入研究。
大隅良典的贡献
大隅良典研究自噬既有其偶然性也有其必然性。1974—1977年他在洛克菲勒大学做博士后,而该大学的前身正是洛克菲勒研究所。当时他的主要课题并不是自噬,在主课题研究停滞不前的时候,他开始了在酵母中研究DNA复制这一副课题,由此,经过一段曲折的经历,逐渐走上研究细胞自噬的道路,从1988年开始以酵母为模型研究自噬。虽然那时距离发现自噬现象已有20多年,但自噬并没有引起科学界的足够重视,似乎没人对它感兴趣。正如瑞士巴塞尔大学的哈尔教授(M. Hall)在接受采访时说的,有关自噬的研究状况可以概括为“波澜不惊”,“基本上被认为是细胞中处理垃圾的系统”,“非特异性地降解垃圾而已”。
大隅良典在1992年发表了他在自噬领域的重要文章。首次报道了在酵母细胞囊泡中因养分缺乏而广泛导致细胞质元件自噬性降解,更为重要的是,他因此能利用各种酵母突变体来确定和研究参与自噬过程的基因[2]。经过上千个酵母突变体的筛选,大隅良典在第二年报道了15个对于自噬过程至关重要的基因[3]。他的发现开启了新的研究方向。从1992年起,包括大隅良典在内的多位科学家分别报道了自噬的相关基因,此后大家意识到自噬在细胞乃至机体存活中的重要意义,并进一步发现自噬在生理和病理上的重要作用,自噬研究成为热点。大隅良典在接受诺奖采访时也表示,在他刚研究自噬的时候,该领域每年仅有不足20篇文章出炉,而到了1990年代,酵母系统被广泛应用于基因研究后,自噬领域的文章已超过5000篇。
2016年诺贝尔生理学或医学奖揭晓时,大家先是惊讶于大隅良典一人独得该奖项,因为其他在自噬领域做出过突出贡献的学者,诸如德国格丁根大学医学院生物化学家图姆(M. Thum)和美国密歇根大学细胞生物学家克林奥斯盖却未被授奖。前者检测到饥饿诱导的无选择性自噬现象,而后者则发现了细胞质到囊泡的靶向通路(cytoplasm-to-vacuole targeting,CVT)。但综合几人的发现及其意义来看,如果只能在自噬研究领域选择一人,则非大隅良典莫属。
自噬的过程及其分子机制
1990年代后,随着自噬被“重新发现”,关于自噬的研究也进入了新的阶段。得益于分子生物学技术的发展,关于自噬的调节和执行机理研究已取得突破,至少33个自噬相关基因(autophagy-related genes,Atg)通过酵母基因筛选的方法被鉴定,其中很多基因在黏菌、植物、蠕虫、果蝇和哺乳类动物中是保守的,再次证明高度保守的自噬过程是细胞最基础的功能之一。
目前定义的自噬有三个类型,其各自的过程稍有不同:大自噬(macro-autophagy),由双层膜结构的囊泡作为载体,包裹细胞质结构形成自噬体,然后与溶酶体融合形成自噬溶酶体并降解内容物;小自噬(micro-autophagy),由溶酶体的膜内陷,直接包裹细胞质元件并在其中降解;分子伴侣介导的自噬(chaperone-mediated autophagy,CMA),细胞内目标蛋白会被分子伴侣蛋白识别并构成复合体,之后被溶酶体膜上受体——溶酶体相关膜蛋白2A(lysosomal-associated membrane protein 2A,LAMP-2A)识别,转运到溶酶体腔内被降解。三种自噬方式都是由溶酶体最终将细胞质元件降解,但分子伴侣介导的自噬在降解蛋白质时有选择性,大自噬与小自噬则无明显的选择性[4]。
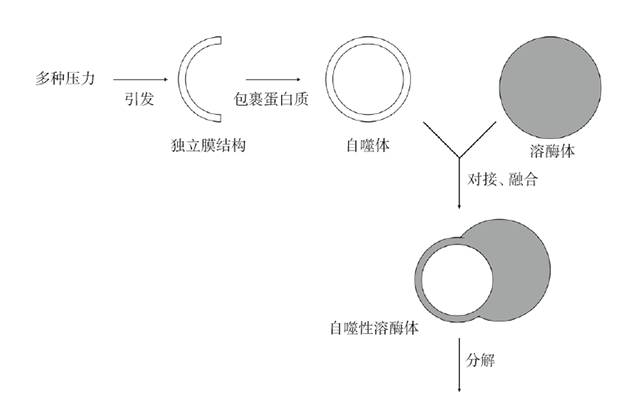
自噬过程简图
在分子水平上,自噬是由自噬相关基因Atg执行并完成的,在自噬过程中有5个关键步骤。先是在多种信号通路调控下,自噬体的膜结构形成;此后Atg5-Atg12结合,与Atg16L相互作用在自噬体膜上形成多聚体;随后微管相关蛋白轻链3(microtubule-associated protein light chain 3, LC3)处理并嵌入延伸的自噬体膜;延伸的膜结构捕获随机或目标蛋白质;最终,自噬体与溶酶体融合,由溶酶体内蛋白水解酶对蛋白质进行降解。
自噬的功能及应用
自噬在近些年得到越来越多的关注,不仅仅是因为发现自噬参与了人类众多的生理机能,还因为自噬是很多疾病发生发展的重要风险因子。诱导或抑制自噬,在疾病治疗上可能有重要的作用。
自噬在细胞水平的多种功能最早是从酵母实验中观察到的。在饥饿环境下酵母细胞中的自噬水平明显提高,这使得酵母能迅速将无用的蛋白质降解为氨基酸,从而合成细胞生存所必需的重要蛋白质。如果用基因突变的方法抑制酵母细胞的自噬水平,突变的酵母细胞则会在饥饿环境中迅速死亡,在饥饿环境下对蛋白质进行降解后再利用的过程中,自噬是必不可缺的。细胞水平的自噬机制在先天免疫中也起着很重要的作用,在感染细胞中刺激诱导产生的自噬有助于病原体的降解。在病毒感染过程中,细胞质中的自噬体会包被病毒并将其运输至内吞体(endosomes),其中的Toll样受体(TLR)会被激活,进而逐级引发信号通路,最终诱导细胞产生干扰素和其他抗病毒的细胞因子。由于自噬在蛋白降解过程中的重要作用,在微生物学中把感染微粒的自噬性降解称为异体吞噬(xenophagy)。此外,自噬还会降解受损的细胞器、细胞膜以及蛋白质,在机体修复中起到重要作用。有实验表明,失去自噬功能会导致细胞内损伤的累积以及细胞老化。在细胞程序性死亡(programmed cell death,PCD)中也观察到自噬体的存在及自噬蛋白的作用[5],不过,目前对于自噬活动在程序性死亡细胞中的活动是导致细胞死亡的原因还是细胞存活的机制尚存在很大争论,但非常确定的是,自噬在其中有重大作用。随着对自噬在细胞水平上的功能认知的日益完善,科学家已经认可自噬是细胞质量控制的重要组成部分。
既然自噬在细胞水平的多种作用都是不可或缺的,它与人类的生存以及疾病的产生和发展的重要关联也就不言而喻了。在营养学研究者看来,利用限制卡路里摄取来维持甚至激活自噬对于延长人类生命可能有很大作用。科研人员在线虫、果蝇和小鼠中通过抑制自噬观察到细胞代谢的压力,而限制饮食很可能因自噬增加而减轻代谢的压力。目前对于自噬有助于延寿的研究仅限于线虫等低等动物,在哺乳动物,由于其研究的复杂性,目前暂无明确的结论。
在人体内,自噬不仅在维持静息状态下的内环境平衡起着不可缺少的作用,在体育锻炼过程中对维持肌体的动态平衡也起着重要作用。当小鼠体内自噬被抑制的情况下,小鼠运动过程中糖代谢受限,耐力明显下降。在骨骼肌中,存在一种特殊的分子伴侣相关的选择性自噬(chaperone-assisted selective autophagy,CASA),CASA分子伴侣复合物识别骨骼肌中运动受损的细胞骨架元件并将其降解。这种特殊自噬过程对于维持肌肉活力是必需的。除了对肌肉稳态维持的作用,自噬在骨关节炎的病情发展中也有重要作用。研究发现,在小鼠和人类,随着年龄的增加,关节软骨和韧带中自噬相关蛋白减少,关节中持续活跃的自噬也随之降低。不仅如此,韧带损伤也会导致自噬相关蛋白减少,提示结构性损伤也会导致自噬的降低[6]。由此可推测,自噬在关节中起到了维持正常功能的保护作用。
癌症中的自噬也是自噬研究领域的一大热点。目前对于自噬在癌症中的利害关系有很大争议,即自噬是保护机体抑制肿瘤产生和增长,还是有助于癌细胞增殖并存活,但这两方都承认自噬在癌症中的重要作用。支持前者观点的实验中,在杂合体小鼠中只具有一个拷贝的调节自噬的基因Beclin 1,小鼠更容易形成肿瘤,而过表达Beclin 1基因则明显抑制肿瘤生长[7];支持后者观点的实验证据则是在癌症治疗中抑制自噬,治疗效果更为明显。也许关于自噬在癌症中的作用与癌症本身的复杂性密不可分。但可以确定的是,把自噬作为癌症治疗的药物靶点在抗癌药物的筛选中是很有意义的。目前无论是支持自噬抑制肿瘤产生的学派,还是支持自噬有助于癌细胞增殖的学派,都将调控自噬视为潜在的癌症治疗药物靶点。
近年来,线粒体疾病的研究也与自噬联系在了一起。神经退行性疾病帕金森病(Parkinson disease)的病因以往被认为是损伤的线粒体累积和蛋白质堆积,最终导致神经元退化。针对原发性帕金森病的研究表明,由于自噬功能受到抑制,受损线粒体会进一步加强细胞的氧化压力,进而导致自噬抑制和细胞内蛋白质堆积,这些又都最终导致线粒体溶胀和去极化[8],由此可见,自噬与帕金森病的发病和发展是密切关联的。
这里必须指出,虽然自噬在疾病发生发展中的作用非常重要,但自噬研究的直接应用价值尚未得以完全体现,后续的深入研究将有助于开发自噬对于人类健康的应用价值。
从大隅良典开拓细胞自噬研究领域以来,包括中国科学家在内的多国科学家都对阐述自噬的机制、自噬在生理和病理上的意义做出了非凡的贡献。以发表自噬研究内容为主的期刊——《自噬》(Autophagy),其主编正是在自噬领域做出过突出贡献的细胞生物学家德迪夫。可能连最初命名自噬的德迪夫都意想不到,自噬已不仅仅是细胞生物学研究中的一个重要内容,它开始向遗传学、生理学、病理学等多学科领域拓展,自噬可以说是生物学研究的一个多学科课题。有理由相信,自噬研究不但让我们对自噬相关疾病发生和发展的机制有更深的认识,也将提供我们更好的攻克癌症、感染、甚至神经退行性疾病等的对策。
刘晗,博士后;戚昀,副研究员;林鑫华,教授,所长:复旦大学生命科学学院遗传学研究所,遗传工程国家重点实验室,遗传与发育协同创新中心,上海 200438。xlin@fudan.edu.cn

发表评论